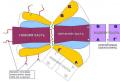
Placenta, tipuri de placenta, bariera placentara.
Placenta leagă fătul de corpul mamei și este formată din părțile fetale (corion vilos) și matern (decidua) (Fig. 20-4 și 20-5). În placentă, vilozitățile coriale care conțin capilarele sanguine ale fătului sunt spălate de sângele gravidei care circulă în spațiul intervilos. Sângele fătului și sângele femeii însărcinate sunt separate de bariera placentară - trofoblastul, stroma vilozităților și endoteliul capilarelor fetale. Transferul substanțelor peste bariera placentară se realizează prin difuzie pasivă (oxigen, dioxid de carbon, electroliți, monozaharide), transport activ (fier, vitamina C) sau difuzie facilitată mediată de purtători (glucoză, Ig).
Orez. 20–5 . Deciduală coajă uter Și placenta. Cavitatea uterină este căptușită de partea parietală a deciduei. Decidua cu fața către corion vilos este parte a placentei.
Fluxul de sânge în placentă
Cordon ombilical, sau cordonul ombilical (Fig. 20-3, 20-4) - o formațiune asemănătoare cordonului care conține două artere ombilicale și o venă ombilicală care transportă sângele de la făt la placentă și înapoi. Arterele ombilicale transportă sânge venos de la făt la vilozitățile coriale din placentă. Prin venă, sângele arterial curge către făt, îmbogățit cu oxigen în capilarele sanguine ale vilozităților. Debitul sanguin volumetric total prin cordonul ombilical este de 125 ml/kg/min (500 ml/min).
Arterial sânge gravidă se injecteaza direct in spatiul intervilos (lacune, vezi Fig. 20-3 si 20-4) sub presiune si socuri de la aproximativ o suta de artere spiralate situate perpendicular pe placenta. Lacunele unei placente complet formate conțin aproximativ 150 ml de vilozități de spălat din sângele matern, înlocuite complet de 3-4 ori pe minut. Din spațiul intervilos, sângele venos curge prin vasele venoase situate paralel cu placenta.
placentară barieră. Bariera placentară (sânge matern sânge fetal) include: sincitiotrofoblast citotrofoblast membrana bazală trofoblastă țesut conjunctiv al vilozităților membrana bazală din peretele capilarelor vilozităților endoteliul vilozității capilare. Prin aceste structuri are loc schimbul dintre sângele femeii însărcinate și sângele fătului. Aceste structuri sunt cele care implementează funcția de protecție (inclusiv imunitară) a fătului.
Funcțiile placentei
Placenta îndeplinește multe funcții, inclusiv transportul nutrienților și oxigenului de la gravidă la făt, îndepărtarea deșeurilor fetale, sinteza proteinelor și hormonilor și protecția imunologică a fătului.
Transport funcţie
Transfer oxigen Și dioxid carbon are loc prin difuzie pasivă.
O 2 . Presiunea parțială a oxigenului (Po 2 ) a sângelui arterial al arteriolelor spiralate la pH 7,4 este de 100 mm Hg cu o saturație de oxigen de Hb de 97,5%. În același timp, sângele Po 2 în partea venoasă a capilarelor fetale este de 23 mm Hg. la 60% saturaţie a Hb cu oxigen. Deși Po 2 din sângele matern scade rapid la 30–35 mm Hg ca urmare a difuziei oxigenului, chiar și această diferență de 10 mm Hg suficient pentru a asigura un aport adecvat de oxigen fatului. Factori suplimentari contribuie la difuzarea eficientă a oxigenului de la mamă la făt.
Hb fetală are o afinitate mai mare pentru oxigen decât Hb definitivă a gravidei (curba de disociere a HbF este deplasată spre stânga). La aceeași Po2, Hb fetală leagă cu 20-50% mai mult oxigen decât Hb maternă.
Concentrația de Hb în sângele fătului este mai mare (acest lucru crește capacitatea de oxigen) decât în sângele mamei. Astfel, în ciuda faptului că saturația fetală de oxigen depășește rar 80%, hipoxia țesutului fetal nu apare.
pH-ul sângelui fetal este mai mic decât pH-ul sângelui integral adult. Odată cu creșterea concentrației ionilor de hidrogen, afinitatea oxigenului pentru Hb scade (efectul Bor a), astfel încât oxigenul este mai ușor transferat din sângele mamei în țesuturile fătului.
CO 2 difuzează prin structurile barierei placentare în direcția gradientului de concentrație (aproximativ 5 mm Hg) dintre sângele arterelor ombilicale (48 mm Hg) și sângele lacunelor (43 mm Hg). În plus, Hb fetală are o afinitate mai mică pentru CO2 decât Hb definitivă maternă.
Uree, creatinina, steroid hormoni, gras acizi, bilirubina. Transferul lor are loc prin difuzie simplă, dar placenta este slab permeabilă la glucuronidele bilirubinei formate în ficat.
Glucoză- difuzie facilitată.
Aminoacizi Și vitamine- transport activ.
Veverițe(de exemplu, transferină, hormoni, unele clase de Ig), peptide, lipoproteinele endocitoză mediată de receptor.
electroliti- Na + , K + , Cl - , Ca 2+ , fosfat - traversează bariera prin difuzie și transport activ.
Imunologic protecţie
Anticorpii materni din clasa IgG transportati prin bariera placentara asigura imunitate pasiva fatului.
Corpul unei femei însărcinate nu respinge un făt străin imunologic din cauza inhibării locale a reacțiilor imunității celulare ale femeii și a absenței glicoproteinelor complexului major de histocompatibilitate (HLA) în celulele corion.
Corionul sintetizează substanțe care inhibă răspunsul imun celular (un extract din sincitiotrofoblast inhibă în vitro reproducerea celulelor sistemului imunitar al gravidei).
Celulele trofoblaste nu exprimă HLA Ag, care asigură protecția complexului fetoplacentar de recunoașterea de către celulele imunocompetente ale gravidei. De aceea, zonele de trofoblast desprinse de placentă, ajungând în plămânii unei femei, nu sunt respinse. În același timp, alte tipuri de celule din vilozitățile placentei poartă Ag HLA pe suprafața lor. De asemenea, trofoblastul nu conține sisteme eritrocitare Ag AB0 și Rh.
Detoxifiere ceva LS.
Endocrin funcţie. Placenta este un organ endocrin. Placenta sintetizează mulți hormoni și alte substanțe biologic active care sunt importante pentru evoluția normală a sarcinii și dezvoltarea fătului (CHT, progesteron, somatomamotropină corionică, factor de creștere a fibroblastelor, transferină, prolactină, relaxine, corticoliberină, estrogeni și altele; vezi Fig. 20). – 6, precum și figurile 20–12 din carte, vezi și tabelele 18–10).
corionic gonadotropină(CHT) menține secreția continuă de progesteron în corpul galben până când placenta începe să sintetizeze progesteron într-o cantitate suficientă pentru cursul normal al sarcinii. Activitatea HCG crește rapid, dublându-se la fiecare 2-3 zile și atingând un vârf în a 80-a zi (80.000-100.000 UI/L), apoi scade la 10.000-20.000 UI/L și rămâne la acest nivel până la sfârșitul sarcinii.
Marker sarcina. HCG este produsă numai de celulele sincitiotrofoblaste. HCG poate fi detectat în serul de sânge al unei femei însărcinate la 8-9 zile după fertilizare. Cantitatea de HCG secretată este direct legată de masa citotrofoblastului. La începutul sarcinii, această circumstanță este utilizată pentru a diagnostica sarcina normală și patologică. Conținutul de HCG în sângele și urina unei femei gravide poate fi determinat prin metode biologice, imunologice și radiologice. Testele imunologice (inclusiv radioimunologice) sunt mai specifice și mai sensibile decât metodele biologice. Cu o scădere a concentrației de HCG la jumătate față de valorile normale, se pot aștepta tulburări de implantare (de exemplu, o sarcină ectopică sau o sarcină uterină nedezvoltată). O creștere a concentrației de HCG peste valorile normale este adesea asociată cu sarcini multiple sau aluniță hidatiformă.
Stimulare secretii progesteron galben corp. Un rol important al HCG este de a preveni regresia corpului galben, care apare de obicei la 12-14 zile dupa ovulatie. Omologia structurală semnificativă între HCG și LH permite HCG să se lege de receptorii luteocitari pentru LH. Acest lucru duce la continuarea activității corpului galben după a 14-a zi din momentul ovulației, ceea ce asigură progresul sarcinii. Începând din săptămâna a 9-a, sinteza progesteronului este efectuată de placentă, a cărei masă permite până în acest moment formarea de progesteron într-o cantitate suficientă pentru a prelungi sarcina (Fig. 20–6).
Stimulare sinteză testosteron celule Leidiga la un fat de sex masculin. Până la sfârșitul primului trimestru, HCG stimulează gonadele fetale să sintetizeze hormonii steroizi necesari diferențierii organelor genitale interne și externe.
Sinteza si secretia de HCG mentine citotrofoblastul secretat gonadoliberină.
Progesteron. În primele 6-8 săptămâni de sarcină, principala sursă de progesteron este corpul galben (conținutul din sângele unei femei gravide este de 60 nmol/l). Începând cu al doilea trimestru de sarcină, placenta devine principala sursă de progesteron (conținut în sânge 150 nmol/l). Corpul galben continuă să sintetizeze progesteron, dar în ultimul trimestru de sarcină, placenta îl produce de 30-40 de ori mai mult. Concentrația de progesteron în sânge continuă să crească până la sfârșitul sarcinii (conținut în sânge 500 nmol/l, de aproximativ 10 ori mai mult decât în afara sarcinii), când placenta sintetizează 250 mg de progesteron pe zi. Pentru a determina conținutul de progesteron, se utilizează o metodă radioimună, precum și nivelul de pregnandiol, un metabolit al progesteronului, cromatografic.
Progesteronul favorizează decidualizarea endometrului.
Progesteronul, inhibând sinteza Pg şi reducând sensibilitatea la oxitocină, inhibă excitabilitatea miometrului înainte de debutul naşterii.
Progesteronul favorizează dezvoltarea alveolelor mamare.

Orez. 20 –6 . Conţinut hormoni V plasmă sânge la sarcina
Estrogenii. În timpul sarcinii, conținutul de estrogeni din sângele unei femei gravide (estronă, estradiol, estriol) este semnificativ crescut (Fig. 20-6) și depășește valorile în afara sarcinii de aproximativ 30 de ori. în care estriol reprezintă 90% din toți estrogenii (1,3 nmol/l la a 7-a săptămână de sarcină, 70 nmol/l la sfârșitul sarcinii). Până la sfârșitul sarcinii, excreția urinară de estriol ajunge la 25-30 mg/zi. Sinteza estriolului are loc în timpul integrării proceselor metabolice ale gravidei, placentei și fătului. Majoritatea estrogenului este secretat de placenta, dar nu sintetizeaza acesti hormoni. de novo, ci doar aromatizarea hormonilor steroizi sintetizați de glandele suprarenale ale fătului. Estriolul este un indicator al funcționării normale a fătului și al funcționării normale a placentei. În scopuri de diagnostic, conținutul de estriol este determinat în sângele periferic și urina zilnică. Concentrațiile mari de estrogen determină o creștere a masei musculare a uterului, a dimensiunii glandei mamare și a organelor genitale externe.
Relaxine- hormoni din familia insulinei - în timpul sarcinii, au un efect relaxant asupra miometrului, înainte de naștere duc la extinderea orificiului uterin și la creșterea elasticității țesuturilor articulației pubiene.
Somatomamotropine 1 Și 2 (lactogenii placentari) se formează în placentă la 3 săptămâni de la fecundare și se pot determina în serul sanguin al unei femei prin radioimunotest din 6 săptămâni de sarcină (35 ng/ml, 10.000 ng/ml la sfârșitul sarcinii). Efectele somatomammotropinelor, ca și cele ale hormonului de creștere, sunt mediate de somatomedine.
Lipoliza. Stimulează lipoliza și crește acizii grași liberi din plasmă (rezerva de energie).
carbohidrați schimb valutar. Suprima utilizarea glucozei și gluconeogeneza la femeile însărcinate.
insulinogen acțiune. Acestea cresc conținutul de insulină din plasma sanguină, reducând în același timp efectele acesteia asupra celulelor țintă.
Lactat glandele. Ele induc (ca prolactina) diferențierea secțiunilor secretoare.
Prolactina. În timpul sarcinii, există trei surse potențiale de prolactină: pituitara anterioară a mamei și a fătului și decidua a uterului. La o femeie care nu este însărcinată, conținutul de prolactină din sânge este în intervalul 8-25 ng / ml, în timpul sarcinii crește treptat până la 100 ng / ml până la sfârșitul sarcinii. Funcția principală a prolactinei este de a pregăti glandele mamare pentru alăptare.
Eliberarea–hormoni. În placentă, toți hormonii de eliberare a hipotalamicului cunoscuți și somatostatina sunt sintetizați (vezi tabelele 18-10).
O persoană este formată din două părți: fructul (de fapt, corionul) și cel matern (endometrul uterului - decidua basalis).
Partea fructului din partea laterală a cavității amniotice este acoperită cu un amnios, care este reprezentat de un epiteliu prismatic cu un singur strat și o placă subțire de țesut conjunctiv. ÎN placa coriala există vase de sânge mari care au venit aici de-a lungul cordonului ombilical. Ele sunt localizate într-un țesut conjunctiv special - țesut mucos. Țesutul mucos apare în mod normal numai înainte de naștere - în cordonul ombilical și placa coriala. Este bogat în glicozaminoglicani, care îi determină turgența ridicată, astfel încât vasele din cordonul ombilical și din placa corială nu sunt niciodată ciupit.
Placa corială este delimitată de spațiul intervilos și fluxul sanguin matern printr-un strat citotrofoblastȘi fibrinoid(Mittabuha). Fibrinoidul îndeplinește o funcție de barieră imuno-biologică. Acesta este un „plastic” la locul de deteriorare a citotrofoblastului, care previne contactul sângelui matern cu sângele și țesuturile fătului, de exemplu. previne conflictul imunitar.
În spațiul intervilos se determină vilozități de diferite diametre. În primul rând, aceasta primar vilozități (de bază).. Ele pot ajunge la straturile adânci ale endometrului și pot crește în el, apoi se numesc ancoră. Alții pot să nu vină în contact cu partea maternă a placentei. Din vilozitățile principale ale ramului de prim ordin vilozități secundare din care ramură vilozități terțiare(de obicei definitivă; numai în condiții nefavorabile de sarcină sau în timpul unei sarcini post-terminate poate apărea ramificarea în continuare a vilozităților).
Vilozitățile terțiare participă în principal la trofismul fetal. Luați în considerare structura lor. Partea centrală a vilozității este ocupată de vase de sânge, înconjurată de țesut conjunctiv. În primele etape, vilozitatea este delimitată de un strat de citotrofoblast, dar apoi celulele sale se contopesc și formează un strat gros. sincitiotrofoblast. Zonele de citotrofoblast rămân doar în jurul plăcilor de ancorare.
Astfel, se formează o barieră placentară între sângele matern și cel fetal. Se prezinta:
Endoteliul capilarelor vilozităților,
membrana bazală a capilarelor,
placă de țesut conjunctiv,
Membrana bazală a citotrofoblastului
Citotrofoblastom sau sincitiotrofoblastom.
Dacă sincitiotrofoblastul este distrus, atunci în această zonă se formează și fibrinoid (Langhans), care acționează și ca o barieră.
Astfel, în bariera placentară, rolul principal îl joacă sincitiul, care este bogat în diverse sisteme enzimatice care asigură îndeplinirea funcțiilor respiratorii, trofice și parțial de sinteză proteică. Prin bariera placentară, din sângele mamei provin aminoacizi, zaharuri simple, lipide, electroliți, vitamine, hormoni, anticorpi, precum și droguri, alcool, droguri etc. Fătul emite dioxid de carbon și diverse deșeuri azotate și, în plus, hormoni fetali, ceea ce duce adesea la o schimbare a aspectului viitoarei mame.
Partea maternă a placentei este reprezentată de un endometru alterat, în care au crescut vilozitățile coriale (adică principala cădere de pe membrană). Este reprezentat de structuri fibroase și un număr mare de celule deciduale foarte mari, care sunt, de asemenea, legate de funcțiile de barieră, trofice și de reglare. Aceste celule rămân parțial în endometru după naștere, împiedicându-le să fie implantate din nou în această zonă. Celulele deciduale sunt înconjurate de fibrinoid (Pora), care separă în general partea maternă a placentei de spațiul intervilos. Fibrinoid Rora îndeplinește și o funcție imunobiologică de barieră.
În stadiul fetal (fetal) al dezvoltării fetale, în conformitate cu programul genetic codificat în genotip, se realizează diferențierea celulară intensivă, formarea și maturarea structurilor de țesut și organ. Masa fătului crește rapid, iar intensitatea creșterii acestuia depinde nu numai de caracteristicile genetice specifice (genotipul), ci și de calitatea hrănirii și de condițiile de păstrare a animalelor gestante. Un sistem circulator fetal independent, autonom este asigurat în mod fiabil de sistemul circulator al corpului mamei, iar legătura fiziologică dintre mamă și făt se realizează printr-un nou organ format în uterul fătului - placenta. În această perioadă de sarcină, condițiile de păstrare și hrănire a animalelor gestante sunt de o importanță deosebită ca factor de creștere a fătului. Cu toate acestea, în implementarea programului genetic, un rol hotărâtor dezvoltat în formarea fătului este atribuit genotipului "noului organism. Placenta (placenta latină, din grecescul placus - tort) este un complex de formațiuni tisulare. care se dezvoltă pe coroida fătului (corion) și în mucoasa uterului și servesc la conectarea fătului cu corpul mamei. Acesta este cel mai important organ trofic și excretor, precum și organul endocrin al fătului, care îndeplinește funcția. ale pielii, plămânilor, intestinelor, asigură nutriția, respirația, excreția produselor metabolice și legătura acesteia cu mediul extern prin sistemul circulator al corpului mamei În straturile celulare ale placentei, procese biochimice complexe de scindare și sinteza proteinelor, au loc grăsimi și alți compuși proveniți din sângele mamei.În vilozitățile corionului și membranele fetale ale placentei, sub acțiunea diferitelor enzime, proteinele cu molecule înalte din sângele mamei sunt împărțite în albumoze și altele, mai simple, compuși chimici disponibili pentru asimilarea de către făt Acești compuși sunt capabili să pătrundă selectiv prin straturile celulare ale placentei din sângele mamei în sângele fetal prin difuzie, osmoză și transfer activ. Placenta este, de asemenea, un organ excretor - eliberează țesuturile fătului de produsele metabolice care se acumulează în sângele său.
Placenta este formată din părți materne și fetale. Materna (placenta uterină) este formată dintr-o membrană mucoasă a uterului alterată în mod deosebit și poate fi în cădere (la primate) și nu (la toate tipurile de animale de fermă). La animalele cu placentă în cădere, partea maternă în timpul nașterii este deteriorată cu o încălcare a integrității vaselor, drept urmare, la astfel de animale, nașterea este însoțită de sângerare. Țesuturile unei placente care nu cade nu sunt deranjate în timpul nașterii.
Placenta fetală (placenta foetalis) este o excrescere (villus) a coroidei fătului (corion), constând din țesut conjunctiv acoperit cu un strat de epiteliu cu cele mai mici capilare terminale ale arterelor și venelor vaselor ombilicale ale fătului. înglobat în fiecare vilozitate. Conexiunea dintre făt și mamă la majoritatea mamiferelor se realizează datorită creșterii vilozităților în adâncirea placentei materne - cripta, în urma căreia sângele mamei și al fătului nu se amestecă. Organismele materne și fetale au sisteme circulatorii autonome. O caracteristică importantă a placentei este prezența în substanța principală a stromei țesutului conjunctiv a unor substanțe foarte active - mucopolizaharide acide implicate în punerea în aplicare a funcției de barieră a țesutului placentar. Permeabilitatea peretelui placentar pentru diferite substanțe și compuși chimici este asociată cu prezența și gradul de polimerizare a acestora.
La diferite specii de animale, în procesul de evoluție, s-au format placente, diferă prin structura straturilor celulare și natura legăturii dintre părțile materne și fetale. Există următoarele tipuri de placente.
Placenta hemocorală
În acest tip de placentă, pe care o au primatele, iepurii și cobai, vilozitățile coriale ale fătului dizolvă stratul celular al mucoasei uterine, lezează pereții vaselor de sânge, rezultând cavități (lacune) pline cu sânge circulant în grosime. a uterului. În aceste cavități sunt localizate vilozitățile, plutind liber și scăldate constant în sânge, iar conexiunile corionului cu peretele uterului sunt localizate local, iar în aparență aceste zone seamănă cu o prăjitură. Sistemul circulator al fătului placentei hemocoriale este separat de sângele mamei numai prin elementele structurale ale vilozităților părții fetale a placentei - epiteliul vilozităților și endoteliul capilarelor. Acest tip de placentă este mai în concordanță cu denumirea hemochorial discoid - hemochorial în structura peretelui corion (celule coriale - sângele mamei) și discoid în natura locației, dispunerea vilozităților pe corion și a criptelor în peretele uterin. . La primate, copilul și părțile materne ale placentei constau din 15-20 de lobuli (discuri).
Placenta endoteliocorială
La fetușii carnivorelor (câini, pisici), vilozitățile coriale nu sunt spălate de sângele mamei, nu sunt direct în sânge, ci cresc în criptele peretelui uterin, căptușite cu endoteliu capilar. Cu această structură a criptelor și a corionului, rețeaua capilară a copilului și părțile materne ale placentei sunt în contact permanent. Sângele matern este separat de sângele fetal prin două straturi de epiteliu și două straturi de endoteliu vascular. Vilozitățile sunt localizate doar în partea de mijloc a corionului (aranjament zonal, spre deosebire de cel discoid la primate), înconjurând vezica fetală sub forma unei benzi late sau brâu. Vilozitățile nu pătrund în lumenul vaselor și nu sunt spălate de sângele mamei, ci cresc adânc în grosimea mucoasei uterine, iar endoteliul capilarelor lor intră în contact direct cu celulele endoteliului capilar al criptelor. a părții materne a placentei. Datorită depunerii de biliverdină, placenta la aceste specii de animale capătă o culoare maro sau verzuie. Acest tip de placentă este numit în mod obișnuit endoteliocorial zonal - endoteliocorial prin natura contactului endoteliului matern, căptușit cu endoteliu vascular cu celule endoteliale ale capilarelor corionului fetal (se formează două straturi de celule epiteliale și două endoteliale) și zonal - prin localizarea zonală, locală, a vilozităților pe corion.
În placentele hemocorial și endoteliochormal, vilozitățile coriale fuzionează strâns cu stratul de suprafață al endometrului pentru a forma membrana deciduală, care este tipică placentelor adevărate. În timpul nașterii, endometrul se desprinde de straturile mai profunde ale mucoasei uterine împreună cu placenta fetală, ceea ce provoacă sângerare semnificativă. Animalele cu placente adevărate se numesc deciduale, au o membrană deciduală în placenta maternă (oameni, maimuțe, rozătoare, carnivore). Alte tipuri de placente, după natura conexiunii dintre membrane și endometru, sunt de obicei numite contact sau semi-placente.
Datorită faptului că în placentele tipurilor hemocorial și endoteliocorial, între sângele fătului și sângele mamei, există doar straturi celulare ale epiteliului și endoteliului capilarelor vaselor de sânge, în timpul sarcinii, proteine materne și imunoglobuline. pătrund din sângele mamei în sângele fătului, iar nou-născuții acestor specii de animale se nasc cu prezența în sânge a unei anumite cantități de proteine de protecție maternă (imunoglobuline). Pătrunde prin placentă în făt, în principal imunoglobuline din clasa G. Alte clase de imunoglobuline, precum și micro și macrofage, celule T și B, nou-născuții le primesc din colostrul mamei după naștere.
Placenta desmocorionica (mixta).
În timpul sarcinii, epiteliul vilozităților părții fetale și epiteliul criptelor părții materne a placentei se desprind din anumite motive, iar țesutul conjunctiv al vilozităților, pătruns de capilarele vasculare, intră în contact cu conjunctiv. tesutul criptelor peretelui uterin (placenta de contact sau semiplacenta). Ca urmare, sistemul vascular fetal este separat de sângele mamei printr-un strat de endoteliu capilar și epiteliul vilozităților coriale ale părții fetale și stroma uterină, celulele epiteliale ale membranei mucoase și epiteliul și endoteliul capilarelor. partea maternă a placentei. Rumegătoarele au acest tip de placentă, numită placentă desmocorală multiplă. Este alcătuit din 80-120 de caruncule care se formează pe mucoasa uterină și tot atâtea placente fetale sub formă de vilozități pe corion - cotiledoane. Nu există vilozități (cotiledoane) în alte părți ale coroidei fătului. Carunculele arată ca formațiuni în formă de ciupercă cu numeroase cripte pătrunse de capilarele vaselor de sânge ale mamei. Vilozitățile coriale, dotate cu un număr mare de vase de sânge (cotiledoane), sunt introduse în criptele carunculelor și au formațiuni emisferice la capăt, ceea ce asigură o circulație a sângelui mai intensă în ele. Prin urmare, în tipul desmocorial al placentei, sângele fetal este separat de sângele mamei printr-un strat de endoteliu capilar și epiteliu corion fetal, un strat de stromă și epiteliu capilar și endoteliul vaselor uterine, ceea ce are un impact semnificativ asupra funcționării. a barierei placentare. La rumegătoare, placenta este considerată a fi placentoame (cotiledoane fetale) și caruncule uterine cu zone intercotiledonale. În conformitate cu aceasta, se disting părțile cotiledonare și intercotiledonare ale placentei. Partea intercotiledonală a placentei la vaci este epiteliocorială, iar partea cotiledonară este desmocorală, care este asociată cu particularitățile celulelor epiteliale ale criptelor carunculare. Mărimea suprafeței părții cotiledonare determină probabil gradul de dezvoltare, intensitatea maturizării și viabilitatea potențială a vițelului nou-născut. La oi, partea cotiledonala a placentei este de tip desmocorial, iar partea intercotiledonara este desmocorial doar pana in saptamana a 10-a de sarcina, iar apoi se transforma in placenta de tip epitelial-corial, asa cum se observa la vaci.
Datorită acestei structuri, placenta rumegătoarelor (vaci, oi, capre) nu trece proteinele și imunoglobulinele prin straturile celulare din sângele mamei în sângele fetal. Prin urmare, vițeii, mieii, iezii imediat după naștere conțin o cantitate redusă de proteine totale în sânge (până la 50-60% din normă) și nu conțin gammaglobuline (imunoglobuline), care au o activitate protectoare ridicată. Imunodeficiența absolută congenitală la nou-născuții acestor specii de animale este o afecțiune fiziologică, normală, dar datorită condițiilor speciale de viață ale nou-născuților, imunodeficiența prezintă un mare pericol pentru viață.
placenta epiteliocorială"
În placenta epiteliocorială (femele cu copite, cămile, porci), vilozitățile fetale și criptele părților materne ale placentei, pe lângă țesutul conjunctiv, sunt căptușite cu celule epiteliale. Această structură a placentelor fetale și materne persistă pe toată perioada sarcinii. Între vasele de sânge ale vilozităților și cripte se formează două straturi de epiteliu, iar spațiul dintre straturi este umplut cu secretul celulelor uterine (embriotrof sau lapte uterin), care este una dintre sursele de nutriție pentru făt. . Placenta epiteliocoriala este morfologic si din punct de vedere al numarului de straturi celulare dintre sangele fetal si cel matern asemanatoare cu placenta desmocoriala. Diferența este că epiteliocorialul nu are caruncule și cotiledoane, dar în plus există două straturi de celule epiteliale, spațiul dintre care este umplut cu lapte uterin (embriotrof).fără sângerare.Straturile celulare ale placentei epiteliocoriale nu permit proteine și gamma globuline (imunoglobuline) din sângele mamei până la sângele fetal, astfel încât mânjii nou-născuți, purceii, cămilele se nasc în stare de imunodeficiență congenitală fiziologică.
Placenta achorial
Unele specii de animale (canguri, balene) sunt echipate cu un tip de placentă achorial - aceasta este o placentă fără vilozități pe corionul fetal. Fătul, al cărui corion este reprezentat de un embriotrof, vine în contact cu suprafața membranei mucoase a uterului, a cărei cavitate este umplută cu lapte uterin. Fătul practic plutește în laptele uterin, folosind nutrienți cu întreaga sa suprafață. Legătura dintre părțile materne și fetale ale placentei se realizează prin embriotrof. Puii născuți din aceste specii de animale au proteine materne și gamma globuline în sânge, adică. nu suferă de imunodeficiență congenitală.
În partea fetală a placentei de toate tipurile, principalele straturi de țesut (endoteliul capilar, mezenchimul și epiteliul corionic) se păstrează pe tot parcursul sarcinii, separând sângele fetal de sângele mamei. În unele tipuri de placentă, straturile de țesut ale uterului (epiteliul uterin, stroma uterină, endoteliul capilar) sunt de asemenea conservate. Straturile de celule enumerate ale părților fetale și materne ale placentei formează bariera placentară. Odată cu scăderea numărului de straturi celulare din bariera placentară, procesele metabolice dintre mamă și făt decurg mai intens. Cu toate acestea, la porcii cu o placentă epiteliocorială cu șase straturi de țesut în bariera placentară (endoteliu capilar, epiteliu și mezenchim corionic, epiteliu și stromă uterin, endoteliu capilar uterin), procesele metabolice sunt foarte intense, așa cum indică creșterea rapidă a fătului. . Un porc nou-născut după aproape 4 luni în uter (în medie trei luni, trei săptămâni și trei zile) crește greutatea corporală la 1 kg sau mai mult, în timp ce un făt uman cu o placentă hemocorală, care include două straturi de țesut (țesut conjunctiv acoperit). cu endoteliul vilozităților coriale, localizat liber în sângele lacunelor uterului), prin această perioadă de fructificare (4 luni) cântărește doar 120 g. între mamă și făt, dar pe caracteristicile genotipului animalului.
Structura și funcția histologică a placentei pe toată lungimea sa și în diferitele stadii de sarcină la unele specii de animale se pot schimba semnificativ. De exemplu, la scroafele din a 7-a săptămână de gestație, intensitatea diferențierii celulelor epiteliului corionic depinde de localizarea acestora. Celulele situate la bază și între micropliuri sunt mai alungite, vacuolate și acoperite cu microvilozități. Se crede că acest epiteliu este implicat în nutriția hemotrofică a fătului. Epiteliul corionului care căptușește crestele micropliurilor seamănă ca structură cu epiteliul alveolelor pulmonare. Aceste zone ale placentei, conform multor cercetători, îndeplinesc funcția de schimb de gaze între sângele mamei și sângele fătului, ceea ce asigură intensificarea proceselor metabolice și redox. O astfel de structură particulară a vilozităților este rezultatul implementării programului genetic pentru dezvoltarea acestui tip de animal, și nu nivelul de nutriție al mamei. Astfel, bariera placentară reglează pătrunderea diferitelor substanțe în sângele fetal din sângele mamei și îndepărtarea produselor metabolice din sângele fetal. Funcția sa vizează protejarea mediului intern al fătului de pătrunderea din sângele mamei a substanțelor aparținând corpului mamei, care sunt străine fătului. Singurele excepții sunt unele clase de imunoglobuline care pot fi transmise prin placenta hemocorală (umană, unele specii de rozătoare) și endoteliocorial in utero. Substratul anatomic al barierei placentare este epiteliul trofoblastului, sincițiul care acoperă vilozitățile, celulele țesutului conjunctiv al vilozităților, endoteliul capilarelor vilozităților și straturile de țesut ale părții materne a placentei. .
În cursul normal al sarcinii, compușii chimici și substanțele cu o anumită greutate moleculară trec din sângele mamei în sângele fetal - compuși cu o greutate moleculară de până la 350 daltoni pătrund liber. Cu cât sunt mai multe straturi de țesut în bariera placentară, cu atât este mai dificil ca compușii chimici cu o masă mai mare să treacă din sângele mamei în sângele fetal. Se crede că o astfel de selectivitate în trecerea compușilor chimici este asociată cu producerea și prezența diferitelor enzime în straturile celulare. Mulți compuși hormonali și umorali cu greutate moleculară mică nu pot pătrunde în bariera placentară. În patologia sarcinii, procesele inflamatorii se pot dezvolta în placentă, precum și diferite anomalii - vilozități, vezicule și deplasări de carne, absența sau subdezvoltarea vilozităților coriale, formarea de placente suplimentare, infarctul părții materne sau fetale a placenta. Orice încălcare a structurii sau „funcției placentei se termină cu respingerea fetală și avortul spontan. Încălcări nesemnificative pot schimba permeabilitatea placentei, ceea ce poate duce la pătrunderea compușilor macromoleculari din sângele mamei în sângele fetal. Prin urmare, funcția a barierei placentare depinde de caracteristicile structurale ale placentei și de starea fiziologică a corpului mamei în perioada de formare a acestuia.Din punct de vedere al stării imunitare a fetușilor animalelor cu placente desmocoriale și epiteliocoriale (rumegătoare, una -animale cu copite, omnivore), principalul lucru poate fi remarcat - fetușii din ei se nasc imaturi fiziologic și cu imunodeficiență severă, care nu ar trebui să fie considerată o patologie.imaturi fiziologic, dar cu o cantitate de proteine totale care se apropie de normă și cu un nivel redus de gamma globuline (imunoglobuline).
Studierea transferului de antibiotice de la mamă la făt, determinarea conținutului acestora în placentă, organele fetale și lichidul amniotic sunt necesare pentru a evalua potențiala toxicitate a acestor medicamente, posibilitatea utilizării lor terapeutice în timpul sarcinii.
Calea principală este difuzia simplă prin placentă. Se datorează diferenței de concentrație a medicamentului în serul sanguin al mamei și al fătului și este determinată de aceiași factori care reglează difuzia medicamentelor prin alte membrane biologice. Acestea includ caracteristicile fiziologice ale sistemului „mamă – placentă – făt” și proprietățile fizico-chimice ale medicamentelor. Printre factorii fiziologici se numără modificările hemodinamice ale corpului mamei și ale fătului, grosimea și gradul de maturitate al placentei și nivelul activității metabolice a țesutului placentar.
Viteza de difuzie prin bariera placentară este direct proporțională cu gradientul de concentrație al substanței în sistemul „mamă – făt”, mărimea suprafeței placentei și invers proporțională cu grosimea acesteia. Medicamente difuze transplacentar mai bune cu greutate moleculară mică (când este mai mare de 1000, transferul de medicamente este limitat), bine solubile în lipide, cu un grad scăzut de ionizare. De mare importanță este gradul de legare a medicamentului de proteinele din sânge, deoarece numai partea liberă (nelegată) a medicamentului difuzează. Prin urmare, antibioticele care se leagă slab la proteinele din sânge, cum ar fi ampicilina (20% de legare), trec prin placentă mai bine decât medicamentele cu un grad ridicat de legare, cum ar fi dicloxacilina (90% de legare).
Gradul de difuzie a antibioticelor prin placenta este influentat de varsta gestationala. Acest lucru se datorează creșterii progresive a numărului de vilozități coriale nou formate, creșterii suprafeței membranei placentare, creșterii circulației sanguine pe ambele părți ale acesteia și modificării grosimii acesteia. La începutul sarcinii, membrana placentară are o grosime relativ mare, care scade treptat pe măsură ce sarcina progresează. În ultimul trimestru, există o scădere pronunțată a stratului epitelial al trofoblastului.
Intensitatea fluxului sanguin matern joacă, de asemenea, un rol semnificativ. După cum știți, în timpul sarcinii, fluxul de sânge în uter crește semnificativ. Suprafața totală a secțiunii transversale a arterelor spiralate este mărită de 30 de ori. Presiunea de perfuzie, care asigură schimbul în spațiul intervilos, crește odată cu creșterea vârstei gestaționale, ceea ce contribuie la un mai bun transfer transplacentar de medicamente, mai ales spre sfârșitul sarcinii.
Dependența gradului de difuzie prin placentă de durata sarcinii este remarcată pentru antibioticele din aproape toate grupurile. Antibioticele din grupa cefalosporinelor (cefazolină, cefotaximă etc.) trec la făt în cantități mult mai mari în trimestrul III de sarcină decât în I și II. Studiile efectuate într-un experiment pe șobolani albi la începutul și sfârșitul sarcinii și în diferite trimestre de sarcină la femei au arătat că odată cu creșterea vârstei gestaționale, gradul de transfer al ceftazidimei (un antibiotic cefalosporin de generația a treia) la făt crește. Aceleași date au fost obținute pentru peniciline, aminoglicozide, macrolide. Studiul efectului antibioticelor asupra fătului, efectuat pe embrioni cultivați in vitro, precum și în condițiile întregului organism, a arătat că acestea nu au efect teratogen. Cu toate acestea, unele antibiotice pot avea un efect embriotoxic, care se efectuează direct și indirect. Deci, aminoglicozidele afectează perechea VIII de nervi cranieni, ceea ce implică o încălcare a dezvoltării organului auditiv: pot avea și un efect nefrotoxic. Tetraciclinele se depun în țesutul osos, perturbă dezvoltarea țesutului dentar și creșterea fetală; cloramfenicolul poate provoca
anemie aplastică și așa-numitul „sindrom gri” (cianoză, tulburări gastrointestinale, vărsături, insuficiență respiratorie, hipotermie, afectare pulmonară acută). Indirect, antibioticele pot avea un efect embriotoxic prin reducerea capacității de transport de oxigen a sângelui mamei, inducerea hipo și hiperglicemiei, reducerea permeabilității placentei pentru vitamine și alți nutrienți și, de asemenea, ca urmare a tulburărilor care conduc la hipotrofia fetală și încetinindu-i dezvoltarea.
Sensibilitatea fătului la medicamentele antibacteriene este diferită în diferite etape ale embriogenezei. În timpul sarcinii, există 5 perioade fundamental importante care determină sensibilitatea embrionului, fătului și nou-născutului la medicamentele antibacteriene: 1 - înainte de fertilizare sau în timpul implantării; a 2-a - perioada postimplantare sau perioada de organogeneză corespunzătoare primului trimestru de sarcină; a 3-a perioadă de dezvoltare fetală, corespunzătoare trimestrului II și III de sarcină; a 4-a perioadă - nașterea; a 5-a - perioada postpartum și alăptarea.
Fătul este cel mai sensibil la antibiotice în perioada postimplantare, adică. în primul trimestru de sarcină, când începe diferențierea embrionului. În trimestrul II și III, riscul de deteriorare este mai mic, deoarece în acest stadiu de dezvoltare, majoritatea organelor și sistemelor fătului sunt deja diferențiate și mai puțin susceptibile la efectele dăunătoare ale medicamentelor. S-a demonstrat că embrionii din perioada de dezvoltare preimplantare au fost mai puțin sensibili la acțiunea antibioticelor în comparație cu embrionii din perioada organogenezei și placentației. Sub influența tetraciclinei și fusidinei în această perioadă, a existat o creștere a morții postimplantare, apariția hipotrofiei fetale și subdezvoltarea placentei.
Substanțele medicinale, în funcție de gradul efectului lor toxic asupra fătului, sunt împărțite în 5 categorii (categorii de risc pentru utilizarea medicamentelor în timpul sarcinii au fost dezvoltate de Administrația SUA pentru Alimente și Medicamente - FDA):
- categoria A - fara risc fetal, siguranta dovedita pentru utilizare in timpul sarcinii;
- categoria B - riscul fetal nu a fost stabilit în studiile pe animale sau pe oameni;
- categoria C - riscul fetal nu a fost stabilit în studii adecvate la om;
- categoria D - există o oarecare posibilitate de risc fetal. Este necesar un studiu suplimentar al medicamentului;
- categoria X - risc fetal dovedit. Utilizarea în timpul sarcinii este contraindicată.
Conform acestei clasificări, toate antibioticele din grupa penicilinei, cefalosporinele, eritromicină, azitromicină, metronidazol, meropenem, nitrofurani, precum și medicamentele antifungice (nistatina, amfotericină B) aparțin categoriei B, tobramicină, amikacina, kanamicina, streptomicina - categoriei. D. Se știe că aminoglicozidele pot avea efecte oto- și nefrotoxice asupra fătului. Când se utilizează gentamicină și amikacină, acest efect este rar (numai cu utilizarea prelungită a dozelor mari de medicamente).
Cloramfenicolul este clasificat în categoria C, la fel ca trimetaprimul, vancomicina și fluorochinolonele. Dintre medicamentele antimicotice, griseofulvina aparține aceleiași categorii. Tetraciclina este în categoria D.
Pentru utilizarea rațională a medicamentelor antibacteriene în timpul sarcinii, ținând cont de efectele secundare asupra mamei, fătului și nou-născutului, antibioticele sunt împărțite în 3 grupuri. Grupa I include antibiotice, a căror utilizare este contraindicată în timpul sarcinii. Include cloramfenicol, tetraciclina, trimetaprim, i.e. substanțe care au efect embriotoxic. Același grup include fluorochinolone, în care experimentul a relevat un efect asupra țesutului cartilaginos al articulațiilor. Cu toate acestea, efectul lor asupra fătului uman este puțin studiat. Grupa II include antibiotice care trebuie utilizate cu prudență în timpul sarcinii: aminoglicozide, sulfonamide (care pot provoca icter), nitrofurani (care pot provoca hemoliză), precum și o serie de medicamente antibacteriene al căror efect asupra fătului nu este bine înțeles. Preparatele din acest grup sunt prescrise femeilor însărcinate numai conform indicațiilor stricte pentru boli grave, ai căror agenți patogeni sunt rezistenți la alte antibiotice sau în cazurile în care tratamentul este ineficient. Grupa III include medicamente care nu au un efect embriotoxic - peniciline, cefalosporine, eritromicină (bază). Aceste antibiotice pot fi considerate medicamentele de elecție în tratamentul bolilor infecțioase la femeile însărcinate.
Mai jos sunt date despre trecerea prin placenta si efectul asupra fatului al antibioticelor, cele mai utilizate in practica obstetricala.
Penicilinele
Gradul de transfer prin placentă de la mamă la făt al medicamentelor din acest grup este determinat de nivelul de legare a proteinelor din sânge. Benzilpenicilina, ampicilina, meticilina sunt puțin legate de proteinele din sânge; se gasesc in sangele si tesuturile fatului la o concentratie mai mare decat oxacilina si dicloxacilina, care au un grad ridicat de legare.
Când benzilpenicilina trece prin placentă, concentrația sa variază de la 10 la 50% din nivelul din sângele matern. Din sângele fătului, medicamentul pătrunde rapid în organele și țesuturile sale. Concentrația terapeutică a antibioticului se găsește în ficat, plămâni și rinichi ai fătului. La sfârșitul sarcinii, gradul de transfer al benzilpenicilinei prin placentă crește.
Conținutul maxim de ampicilină în serul sanguin al fătului se determină la 2 ore după injectarea intramusculară și este de 20% din concentrația din sângele mamei. Cantitatea sa în lichidul amniotic crește mai lent decât în sângele mamei și al fătului, dar este reținută pentru o perioadă mai lungă într-o concentrație activă terapeutic. Preparatele din grupa penicilinei nu au efecte teratogene și embriotoxice. Este posibil un efect alergic asupra fătului.
În prezent interesează transferul prin placentă a așa-numitelor peniciline protejate - o combinație de peniciline cu acid clavulanic și sulbactam, cel mai frecvent utilizată pentru tratarea proceselor inflamatorii. Efectul acestor combinații asupra fătului nu a fost încă studiat suficient. Se știe că ampicilină/sulbactam traversează rapid placenta la concentrații scăzute. La utilizarea acestui antibiotic, s-a observat o scădere a nivelului de estriol în plasma sanguină și excreția acestuia în urină. Determinarea estriolului în urină este utilizată ca test și în evaluarea stării sistemului fetoplacentar. O scădere a nivelului său poate fi un semn al dezvoltării unui sindrom de suferință.
Amoxicilina / acidul clavulanic, precum și amoxicilina în sine, traversează bine placenta și creează concentrații mari în țesuturile fătului. Nu sunt disponibile date privind efectele nocive ale acestui antibiotic și combinația sa cu acidul clavulanic. Cu toate acestea, din cauza necunoașterii acestei probleme, a lipsei de studii controlate, nu se recomandă utilizarea penicilinelor protejate în primul trimestru de sarcină; în trimestrul II și III, acestea trebuie utilizate cu prudență.
De asemenea, piperacilina traversează cu ușurință placenta: la 30 de minute după administrarea antibioticului la mamă, se determină în țesuturile fătului în concentrație activă terapeutic. Antibioticul trece și în lichidul amniotic, unde nivelul său atinge concentrația minimă inhibitorie. Carbapenemele (imipenem, meropenem) au capacitatea de a se acumula în lichidul amniotic, iar concentrația lor în acesta este mai mare decât cea din serul sanguin al mamei cu 47%. Această caracteristică trebuie luată în considerare la readministrarea antibioticelor.
Cefalosporine
De asemenea, antibioticele din acest grup traversează bine bariera placentară. Gradul de trecere transplacentară a cefalosporinelor este determinat în mare măsură de durata sarcinii: în primele luni este scăzut și crește spre sfârșitul sarcinii. Acest model se aplică cefalosporinelor din diferite generații. Astfel, o comparație a cineticii cefradinei în trimestrul I și III de sarcină după o perfuzie intravenoasă de 2 g de medicament a arătat că conținutul antibioticului în țesuturile fătului, sângele din cordonul ombilical, membranele fetale și lichidul amniotic este semnificativ mai mare în etapele ulterioare. Gradul de tranziție transplacentară a ceftazidimei la femeile în al treilea trimestru crește de aproape 3 ori. Modele similare au fost observate pentru alte cefalosporine din generații diferite.
Atunci când femeilor însărcinate se administrează doze terapeutice de cefalosporine în sângele fătului, în lichidul amniotic, se creează o concentrație de medicamente care este mai mare decât suprimarea minimă a agenților patogeni ai infecției intrauterine. Datele experimentale și clinice indică absența proprietăților teratogene și embriotoxice în prima și a doua cefalosporine, precum și în unele medicamente de a treia generație.
Aminoglicozide
Transferul aminoglicozidelor prin placentă și efectul acestora asupra fătului nu au fost suficient studiate din cauza utilizării limitate a acestor medicamente în timpul sarcinii din cauza posibilelor efecte toxice. Puține studii indică o bună penetrare a acestui grup de antibiotice prin bariera placentară; după introducerea lor la o femeie însărcinată, concentrația în sângele din cordonul ombilical ajunge la 30-50% din nivelul din sângele mamei. În placentă, aminoglicozidele se acumulează în cantitate semnificativă, apropiindu-se de nivelul din sângele din cordonul ombilical. Gentamicina traversează placenta la concentrații moderate. În lichidul amniotic, apare mai târziu decât în sângele din cordonul ombilical, totuși, în sângele fătului și în lichidul amniotic, nivelul antibioticului atunci când se administrează doze terapeutice mamei depășește concentrația minimă inhibitorie pentru un număr. a agenților infecțioși. Utilizarea lui în timpul sarcinii nu este recomandată din cauza riscului de ototoxicitate. Netilmicina se deosebește de alte antibiotice din grupa aminoglicozidelor printr-un grad mai mare de siguranță clinică, un indice terapeutic mai mare. Traversează placenta în concentrații mari și produce concentrații active terapeutic în sângele din cordonul ombilical și lichidul amniotic. Cu toate acestea, siguranța sa în sarcină nu a fost suficient studiată, iar utilizarea sa cu prudență este recomandată numai atunci când este absolut necesar, precum și alte aminoglicozide.
Dintre celelalte antibiotice din grupa aminoglicozidelor, trecerea transplacentară a kanamicinei este relativ bine studiată; concentrația antibioticului în sângele fătului după injectarea sa intramusculară este de 50-70% din nivelul din sângele mamei. Conținutul de kanamicină în organele fătului este oarecum mai mic - 30-50%, pătrunde în lichidul amniotic în cantități limitate.
Influența semnificativă asupra trecerii aminoglicozidelor prin placentă are o vârstă gestațională. A existat o scădere a permeabilității placentei pentru gentamicina la sfârșitul sarcinii. Poate că acest lucru se datorează concentrației mai scăzute a antibioticului în sângele mamei în această perioadă. Tranziția altor aminoglicozide crește odată cu creșterea vârstei gestaționale. Studiile efectuate pe animale, precum și datele obținute în clinică, indică absența unui efect teratogen al antibioticelor din acest grup.
Administrarea streptomicinei și dihidrostreptomicinei la gravide poate provoca efecte ototoxice la nou-născuți. Alte aminoglicozide cauzează rareori leziuni ale nervului auditiv. Cu toate acestea, aceste medicamente nu trebuie utilizate în timpul sarcinii. Excepție fac procesele infecțioase severe în absența unei metode alternative de tratament; într-o astfel de situație, acestea sunt prescrise în cure scurte sau o singură doză zilnică.
Cloramfenicol
Traversează rapid bariera placentară, concentrația antibioticului în sângele fătului ajunge la 30-70% din nivelul din sângele mamei. Cloramfenicolul nu trebuie utilizat în timpul sarcinii, din cauza potențialului său de a provoca complicații grave materne și efecte toxice asupra fătului. Nou-născuții născuți din femeile tratate cu acest medicament în timpul sarcinii pot dezvolta așa-numitul „sindrom gri”. Sindromul este cauzat de incapacitatea ficatului și a rinichilor nou-născutului de a metaboliza și elimina antibioticul. Mortalitatea cu ea ajunge la 40%.
Tetracicline
Tetraciclinele traversează liber bariera placentară, concentrația lor în sângele fătului variază de la 25-75% din nivelul din sângele mamei. Concentrația antibioticului în lichidul amniotic nu depășește 20-30% din nivelul din sângele fătului. Preparatele din grupul tetraciclinei au un efect embriotoxic pronunțat, manifestat printr-o încălcare a dezvoltării scheletului fătului și a țesutului dentar. Mecanismul de acțiune al tetraciclinei asupra fătului este asociat cu interferența acesteia cu sinteza proteinelor, interacțiunea cu calciul și alți cationi implicați în procesul de mineralizare osoasă a scheletului. Un posibil punct de aplicare al influenței tetraciclinei este mitocondriile celulelor implicate în aceste procese. Efectul tetraciclinei asupra creșterii scheletice începe să se manifeste în al doilea trimestru de sarcină, când apar centrii de osificare. Din cauza embriotoxicității severe, tetraciclinele nu sunt recomandate în timpul sarcinii.
macrolide
Antibioticele din acest grup trec prin bariera placentară, dar nivelul lor în sângele fetal este scăzut, precum și în lichidul amniotic. Macrolidele nu au un efect advers asupra mamei și fătului. Medicamentele sunt recomandate pentru utilizare în timpul sarcinii (cu alergii la peniciline și cefalosporine) pentru tratamentul proceselor purulent-inflamatorii.
În ceea ce privește eritromicina, nu există date privind creșterea frecvenței malformațiilor congenitale ale fătului după administrarea acesteia. Antibioticul traversează placenta la concentrații scăzute. În timpul sarcinii, este contraindicată utilizarea de eritromicină-estolat.
Azitromicina este utilizată pe scară largă pentru a trata infecția cu chlamydia. Pentru o lungă perioadă de timp, nu a fost recomandat pentru utilizare în timpul sarcinii din cauza lipsei de date privind efectul antibioticului asupra fătului. Recent, au existat studii care arată absența efectelor adverse. De asemenea, au fost obținute date despre posibilitatea utilizării acestuia pentru tratamentul infecției cu chlamydia la femeile însărcinate.
Efectul altor macrolide asupra fătului (claritromicină, spiramicină, roxitromicină, josamicina) nu a fost studiat practic, drept urmare utilizarea lor în timpul sarcinii nu este recomandată.
Dintre glicopeptide, vancomicina traversează placenta în concentrații relativ mari. Există rapoarte de pierdere a auzului la nou-născuți atunci când mama este tratată cu vancomicină. În primul trimestru de sarcină, utilizarea acestui antibiotic este interzisă, în trimestrul II și III trebuie utilizat cu prudență (din motive de sănătate).
Metronidazol. Medicamentul traversează rapid placenta și creează concentrații în sângele fătului care se apropie de nivelul din sângele mamei. În lichidul amniotic, conținutul acestuia este, de asemenea, relativ ridicat (50-75% din nivelul din sângele fătului). Nu există raportări de efecte adverse ale metronidazolului asupra fătului, cu toate acestea, datorită datelor disponibile privind efectul carcinogen asupra rozătoarelor și mutagenitatea asupra bacteriilor, obstetricienii se abțin de la utilizarea medicamentului pe cale orală și parenteral în timpul sarcinii (în special în primul trimestru).
Clindamicina și lincomicina ele pătrund bine prin placentă până la făt atunci când sunt administrate la femei atât în prima jumătate a sarcinii, cât și la sfârșitul acesteia. În același timp, se creează o concentrație mai mare a medicamentului în organele fătului - ficat, rinichi, plămâni, decât în sângele fetal. Cu toate acestea, informațiile despre efectul medicamentelor asupra fătului sunt insuficiente, drept urmare acestea sunt utilizate cu prudență în timpul sarcinii.
Sulfonamide de asemenea, pătrund ușor în placentă, trec în sângele și țesuturile fătului, în lichidul amniotic. Efectul toxic direct al medicamentelor din acest grup asupra fătului nu a fost stabilit. Cu toate acestea, sulfonamidele concurează cu bilirubina pentru locul de legare cu proteine, drept urmare nivelul de bilirubină liberă din serul sanguin al nou-născutului poate crește și, prin urmare, crește riscul de a dezvolta icter.
Fluorochinolone traversează placenta în concentrații mari. Nu au nici efecte teratogene, nici embriotoxice. Nici acțiunea lor mutagenă nu a fost găsită. Există date experimentale privind efectul negativ al fluorochinolonelor asupra creșterii și dezvoltării țesutului cartilajului la animalele imature. Un efect similar asupra țesutului cartilajului la om nu a fost observat, cu toate acestea, din cauza studiului insuficient al efectului fluorochinolonelor asupra fătului, utilizarea acestor medicamente în timpul sarcinii și alăptării nu este recomandată.