Внутриутробные инфекции: корь, краснуха, сифилис и спид – чем грозят они ребенку? Внутриутробные инфекции у новорожденных.
Вынашивая ребенка, женщина старается оградить его от неблагоприятных внешних воздействий. Здоровье развивающегося малыша – это самое главное в этот период, на его сохранение направлены все защитные механизмы. Но бывают ситуации, когда организм не справляется, и плод поражается внутриутробно – чаще всего речь идет об инфекции. Почему она развивается, чем проявляется и какие риски несет для ребенка – вот основные вопросы, волнующие будущих мам.
Причины
Чтобы появилась инфекция, в том числе и внутриутробная, необходимо присутствие нескольких моментов: возбудителя, пути передачи и восприимчивого организма. Непосредственной причиной заболевания считают микробов. Перечень возможных возбудителей очень широк и включает различных представителей – бактерий, вирусов, грибов и простейших. Следует отметить, что внутриутробное заражение в основном обусловлено микробными ассоциациями, т. е. имеет смешанный характер, но нередки и моноинфекции. Среди распространенных возбудителей стоит отметить следующие:
- Бактерии: стафило-, стрепто- и энтерококки, кишечная палочка, клебсиелла, протей.
- Вирусы: герпеса, краснухи, гепатита B, ВИЧ.
- Внутриклеточные агенты: хламидии, микоплазмы, уреаплазмы.
- Грибки: кандиды.
- Простейшие: токсоплазмы.
Отдельно была выделена группа инфекций, которые, несмотря на все различия в морфологии и биологических свойствах, вызывают сходную симптоматику и ассоциируются со стойкими дефектами развития у плода. Они известны под аббревиатурой TORCH: токсоплазма, краснуха, цитомегаловирус, герпес и другие. Нужно также сказать, что за последние годы произошли определенные изменения в структуре внутриутробных инфекций, что связано с усовершенствованием методов диагностики и выявлением новых возбудителей (например, листерий).
Инфекция может проникнуть к ребенку несколькими путями: через кровь (гематогенно или трансплацентарно), околоплодные воды (амниально), половые пути матери (восходяще), из стенки матки (трансмурально), по фаллопиевым трубам (нисходяще) и с непосредственным контактом. Соответственно, есть определенные факторы риска заражения, о которых следует помнить женщине и врачу:
- Воспалительная патология гинекологической сферы (кольпиты, цервициты, бактериальный вагиноз, аднекситы, эндометриты).
- Инвазивные вмешательства при беременности и в родах (амнио- или кордоцентез, биопсия хориона, кесарево сечение).
- Аборты и осложнения в послеродовом периоде (перенесенные ранее).
- Недостаточность шейки матки.
- Многоводие.
- Фетоплацентарная недостаточность.
- Общие инфекционные заболевания.
- Очаги хронического воспаления.
- Раннее начало половой жизни и неразборчивость в сексуальных связях.
Кроме того, многие инфекции характеризуются латентным течением, подвергаясь реактивации при нарушениях обменных и гормональных процессов в женском организме: гиповитаминозе, анемии, тяжелых физических нагрузках, психоэмоциональных стрессах, эндокринных расстройствах, обострении хронических заболеваний. Те, у которых выявлены подобные факторы, относятся к группе высокого риска внутриутробного инфицирования плода. Им же показан регулярный мониторинг состояния и профилактические мероприятия, направленные на минимизацию вероятности развития патологии и ее последствий.
Внутриутробная инфекция развивается при заражении микробами, чему способствует множество факторов со стороны материнского организма.
Механизмы
Степень патологического воздействия определяется особенностями морфологического развития плода на том или ином сроке беременности, его реакцией на инфекционный процесс (зрелостью иммунной системы), длительностью микробной агрессии. Тяжесть и характер поражения далеко не всегда строго пропорциональны вирулентности возбудителя (степени его патогенности). Нередко латентная инфекция, вызванная хламидийными, вирусными или грибковыми агентами, приводит к внутриутробной гибели или рождению ребенка с серьезными отклонениями. Это обусловлено биологическим тропизмом микробов, т. е. склонностью к размножению в эмбриональных тканях.
Инфекционные агенты оказывают различное воздействие на плод. Они могут провоцировать воспалительный процесс в различных органах с дальнейшим развитием морфофункционального дефекта или оказывать прямой тератогенный эффект с появлением структурных аномалий и пороков развития. Немаловажное значение имеют интоксикация плода продуктами микробного метаболизма, расстройства обменных процессов и гемоциркуляции с гипоксией. В результате страдает развитие плода и нарушается дифференцировка внутренних органов.
Симптомы
Клинические проявления и тяжесть инфекции определяются многими факторами: видом и характеристиками возбудителя, механизмом его передачи, напряженностью иммунитета и стадией патологического процесса у беременной, сроком гестации, на котором произошло заражение. В общем виде этом можно представить следующим образом (таблица):
Симптоматика внутриутробной инфекции заметна сразу после рождения или в первые 3 суток. Но следует помнить, что некоторые заболевания могут иметь более длинный инкубационный (скрытый) период или, наоборот, появляться раньше (например, у недоношенных детей). Чаще всего патология проявляется синдромом инфицированности новорожденного, проявляющимся следующими признаками:
- Ослабление рефлексов.
- Гипотония мышц.
- Отказ от кормления.
- Частые срыгивания.
- Бледность кожи с периодами цианоза.
- Изменение ритма и частоты дыхания.
- Приглушенность сердечных тонов.
Специфические проявления патологии включают широкий спектр нарушений. Исходя из тканевого тропизма возбудителя, внутриутробная инфекция при беременности может проявляться:
- Везикулопустулезом: сыпь на коже в виде пузырьков и гнойничков.
- Конъюнктивитами, отитами и ринитами.
- Пневмонией: одышка, синюшность кожи, хрипы в легких.
- Энтероколитом: поносы, вздутие живота, вялое сосание, срыгивание.
- Менингитом и энцефалитом: слабые рефлексы, рвота, гидроцефалия.
Наряду с локальным патологическим процессом, заболевание может иметь распространенный характер – в виде сепсиса. Однако его диагностика у новорожденных затруднена, что связывают с низкой иммунной реактивностью организма ребенка. Сначала клиника довольно скудна, поскольку присутствуют лишь симптомы общей интоксикации, включая уже перечисленные выше. Кроме того, у малыша наблюдается дефицит массы тела, плохо заживает пупочная ранка, появляется желтуха, увеличиваются печень и селезенка (гепатоспленомегалия).
У детей, зараженных во внутриутробном периоде, выявляются нарушения со стороны многих жизненно важных систем, включая нервную, кардиоваскулярную, дыхательную, гуморальную, иммунную. Нарушаются ключевые адаптационные механизмы, что проявляется гипоксическим синдромом, гипотрофией, церебральными и обменными расстройствами.
Клиническая картина внутриутробных инфекций очень разнообразна – она включает специфические и общие признаки.
Цитомегаловирус
У большинства детей, инфицированных цитомегаловирусом, при рождении нет никаких видимых отклонений. Но в дальнейшем выявляют признаки неврологических нарушений: глухоту, замедление нейропсихического развития (легкая умственная отсталость). К сожалению, эти расстройства имеют необратимый характер. Они могут прогрессировать с развитием церебрального паралича или эпилепсии. Кроме того, врожденная инфекция может проявляться:
- Гепатитом.
- Пневмонией.
- Гемолитической анемией.
- Тромбоцитопенией.
Указанные нарушения исчезают на протяжении определенного периода даже без лечения. Может возникать хориоретинопатия, которая редко сопровождается снижением зрения. Тяжелые и жизнеугрожающие состояния бывают очень редко.
Герпетическая инфекция
Наибольшую опасность для плода представляют первичная генитальная инфекция у матери или обострение хронической болезни. Тогда ребенок заражается контактно, проходя при родах через пораженные половые пути. Внутриутробное инфицирование случается реже, оно возникает перед естественным завершением беременности, когда лопается плодный пузырь, или на других сроках – с первого по третий триместр.
Инфицирование плода в первые месяцы беременности сопровождается пороками сердца, гидроцефалией, аномалиями пищеварительной системы, задержкой внутриутробного развития, самопроизвольными абортами. Во втором и третьем триместрах патология приводит к появлению следующих отклонений:
- Анемии.
- Желтухи.
- Гипотрофии.
- Менингоэнцефалита.
- Гепатоспленомегалии.
А герпес-инфекция у новорожденных диагностируется по пузырьковому (везикулярному) поражению кожи и слизистых, хориоретиниту и энцефалиту. Встречаются и распространенные формы, когда в патологический процесс вовлечены несколько систем и органов.
Краснуха
Ребенок может инфицироваться от матери на любом сроке беременности, а от времени заражения будут зависеть и клинические проявления. Болезнь сопровождается поражением плаценты и плода, внутриутробной гибелью последнего или вовсе не дает никаких последствий. Для детей, родившихся с инфекцией, характерны довольно специфические аномалии:
- Катаракта.
- Глухота.
- Сердечные пороки.
Но помимо этих признаков, могут встречаться и другие структурные отклонения, например, микроцефалия, «волчья пасть», нарушения скелета, мочеполовой системы, гепатит, пневмония. Но у многих детей, родившихся инфицированными, никакой патологии не выявляют, а в первые пять лет жизни начинаются проблемы – ухудшается слух, замедляется психомоторное развитие, появляется аутизм, сахарный диабет.
Краснуха обладает четким тератогенным воздействием на плод, приводя к различным аномалиям, или провоцирует его гибель (самопроизвольный аборт).
Токсоплазмоз
Заражение токсоплазмозом на ранних сроках беременности может сопровождаться тяжелыми последствиями для плода. Внутриутробная инфекция провоцирует гибель ребенка или возникновение у него множественных аномалий, включая гидроцефалию, кисты головного мозга, отечный синдром и разрушение внутренних органов. Врожденное заболевание часто имеет распространенный характер, проявляясь таким симптомами:
- Анемией.
- Гепатоспленомегалией.
- Желтухой.
- Лимфаденопатией (увеличением лимфатических узлов).
- Лихорадкой.
- Хориоретинитом.
При инфицировании на более поздних сроках клинические проявления довольно скудны и в основном характеризуются снижением зрения или невыраженными нарушениями в нервной системе, которые зачастую остаются не выявленными.
Дополнительная диагностика
Важное значение принадлежит пренатальной диагностике инфекционного поражения плода. Для определения патологии используют лабораторные и инструментальные методы, позволяющие идентифицировать возбудителя и выявить отклонения в развитии ребенка на различных сроках беременности. При подозрении на внутриутробное инфицирование выполняют:
- Биохимический анализ крови (антитела или микробные антигены).
- Анализ мазков из половых путей и околоплодных вод (микроскопия, бактериология и вирусология).
- Генетическая идентификация (ПЦР).
- УЗИ (фетометрия, плацентография, допплерография).
- Кардиотокография.
После рождения обследуют новорожденных (смывы с кожи, анализ крови) и плаценту (гистологическое исследование). Комплексная диагностика позволяет выявить патологию еще на доклиническом этапе и спланировать дальнейшее лечение. Характер проводимых мероприятий будет определяться видом инфекции, ее распространением и клинической картиной. Большую роль также играет пренатальная профилактика и правильное ведение беременности.
Внутриутробные инфекции (ВУИ, врождённые инфекции, TORCH-синдром) - группа инфекционно-воспалительных заболеваний плода и новорождённого, вызванных различными возбудителями, но характеризующихся общими эпидемиологическими закономерностями и нередко имеющими сходные клинические проявления. Для обозначения внутриутробных инфекций, манифестирующих с первого дня жизни, используют также термин «TORCH-синдром». Данный термин образован первыми буквами латинских названий наиболее часто верифицируемых врождённых инфекций: T - токсоплазмоз (Тoxoplasmоsis ), R - краснуха (Rubella ), С - цитомегалия (Cytomegalia ), Н - герпес (Herpes ) и О - другие инфекции (Оther ). К последним относят сифилис, листериоз, вирусные гепатиты, хламидиоз, ВИЧ-инфекция, микоплазмоз и др. Врождённые инфекции возникают в результате внутриутробного (антенатального или интранатального) инфицирования плода. При этом в большинстве случаев источником инфекции для плода является мать. В последние годы использование инвазивных методов пренатальной диагностики и лечения (амниоцентез, пунктирование сосудов пуповины и др.) и внутриматочное введение препаратов крови через сосуды пуповины (переливание эритроцитарной массы плоду при гемолитической болезни), а также пролонгирование беременности при преждевременном разрыве околоплодных оболочек предрасполагают к ятрогенному внутриутробному инфицированию плода.
Эпидемиология
Истинная частота врождённых инфекций до настоящего времени не установлена, однако по данным ряда авторов распространённость внутриутробного инфицирования в человеческой популяции может достигать 10–15%. ВУИ относят к тяжёлым заболеваниям, которые во многом определяют уровень младенческой смертности. При этом актуальность проблемы ВУИ обусловлена не только существенными перинатальными и постнатальными потерями, но и нередким возникновением неблагоприятных отдалённых последствий для здоровья, приводящих к инвалидности у детей, перенёсших тяжёлые формы врождённой инфекции.
Этиология и патогенез.
Основным источником инфекции при ВУИ является мать ребёнка, от которой возбудитель в антенатальном или интранатальном периоде проникает в организм плода. При этом вертикальная передача инфекции может быть осуществлена трансовариальным, трансплацентарным и восходящим путями в антенатальный период, а также контактным путём во время родов. Антенатальное инфицирование в большей степени характерно для вирусов (ЦМВ, вирус краснухи, Коксаки и др.), токсоплазмы и микоплазмы. Интранатальная контаминация более характерна для бактерий и грибов. При этом спектр возбудителей интранатальной инфекции значительно разнообразней и зависит от особенностей микробного пейзажа слизистых оболочек родовых путей матери. Наиболее часто в этот период происходит инфицирование плода такими микроорганизмами, как стрептококки группы В, энтеробактерии, эшерихии коли, а также вирусы простого герпеса, ВИЧ, микоплазмы, уреаплазмы, хламидии и др. В настоящее время известно более 100 микроорганизмов, способных вызывать ВУИ. Помимо «классических» возбудителей TORCH-инфекции, показано патогенное влияние на человеческий плод энтеровирусов, ВИЧ, хламидий, микоплазмы (Ureaplasma urealyticum , Mycoplasma hominis ), вирусов гриппа, парагриппа, аденовирусов, парвовирусов B16, герпес-вирусов 4 и 6 типов и др.
При высокой распространённости внутриутробного инфицирования потенциальная угроза внутриутробной трансмиссии инфекционных агентов от матери к ребёнку существенно возрастает в тех случаях, когда женщина имеет отягощённый соматический, акушерско-гинекологический и инфекционный анамнез. При этом риск инфицирования повышают воспалительные заболевания урогенитального тракта, неблагоприятное течение беременности (тяжёлые гестозы, угроза прерывания, патологическое состояние маточно-плацентарного барьера, инфекционные заболевания). Развитие манифестных форм инфекционного заболевания во многом зависит и от состояния новорождённого. Так, риск реализации врождённой инфекции значительно возрастает при недоношенности; задержке пренатального развития; перинатальном поражении ЦНС; патологическом течении интранатального или раннего неонатального периода.
Помимо этого, прогноз внутриутробной инфекции зависит от срока гестации, в котором произошло инфицирование, особенностей возбудителя (патогенных и иммуногенных его свойств), длительности течения инфекции у матери (первичная или вторичная), функционального состояния иммунной системы матери, целостности маточно-плацентарного барьера и др.
Инфекция называется первичной в том случае, если организм матери инфицируется данным возбудителем впервые во время беременности. О первичном характере инфекции можно говорить, если специфические АТ (IgМ, IgG) обнаруживают у ранее серонегативного пациента. Если же инфекционный процесс развивается в результате активизации возбудителя, находившегося до этого в организме в латентном состоянии (реактивация), или из-за повторного инфицирования (реинфекция), то такую инфекцию классифицируют как вторичную. Наиболее часто инфицирование плода и развитие тяжёлых форм ВУИ отмечают в тех случаях, когда во время беременности женщина переносит первичную инфекцию.
В тех случаях, когда инфицирование происходит в период эмбриогенеза, чаще отмечаются самопроизвольные выкидыши или возникают тяжёлые, несовместимые с жизнью пороки развития. Проникновение возбудителя в организм плода в ранний фетальный период приводит к развитию инфекционно-воспалительного процесса, который характеризует преобладание альтернативного компонента и формирование в повреждённых органах фиброзно-склеротических деформаций. При этом нередко возникает первичная плацентарная недостаточность, сопровождающаяся хронической внутриутробной гипоксией плода и развитием симметричной ЗВУР. Инфицирование плода в поздний фетальный период сопровождает как воспалительное повреждение отдельных органов и систем (гепатит, кардит, менингит или менингоэнцефалит, хориоретинит, поражение кроветворных органов с развитием тромбоцитопении, анемии и др.), так и генерализованное поражение. При антенатальном инфицировании плода беременность, как правило, заканчивается преждевременными родами, а клинические симптомы инфекционного заболевания проявляются уже при рождении. В то же время при интранатальном заражении плода сроки реализации инфекционно-воспалительного процесса часто сдвинуты от момента родов, в результате чего манифестация внутриутробной инфекции может произойти не только в первые недели жизни, но даже и в постнеонатальный период. Тем не менее, в подавляющем большинстве случаев внутриутробной инфекции клинические проявления заболевания дебютируют в неонатальный период.
Классификация.
Учитывая тот факт, что эффективное лечение инфекций, в том числе и внутриутробных, возможно только при адекватной этиотропной терапии, в практической неонатологии наиболее приемлемой следует считать классификацию, построенную по этиологическому принципу. В соответствии с МКБ-10, врождённые инфекции представлены в классе XVI «Отдельные состояния, возникающие в перинатальном периоде» в блоках Р35–Р39 «Инфекционные болезни, специфичные для перинатального периода».
Инфекционные болезни, специфичные для перинатального периода (Р35–Р39):
P35 Врождённые вирусные болезни.
P35.0 Синдром врождённой краснухи.
P35.1 Врождённая цитомегаловирусная инфекция.
P35.2 Врождённая инфекция, вызванная вирусом простого герпеса (Herpes simplex ).
P35.8 Другие врождённые вирусные инфекции.
P35.9 Врождённая вирусная болезнь неуточнённая.
P37.0 Врождённый туберкулёз.
P37.1 Врождённый токсоплазмоз.
P37.2 Неонатальный (диссеминированный) листериоз.
P37.3 Врождённая малярия, вызванная Plasmodium falciparum.
P37.4 Другая врождённая малярия.
P39 Другие инфекционные болезни, специфичные для перинатального периода.
P39.2 Внутриамниотическая инфекция плода, не классифицированная в других рубриках.
P39.8 Другая уточнённая инфекция, специфичная для перинатального периода.
P39.9 Инфекция, специфичная для перинатального периода, неуточнённая.
Клинические проявления
С практической точки зрения целесообразно выделять инфекции, клинические проявления которых возникли до рождения ребёнка (истинно врождённые инфекции), и перинатальные инфекции, клинические проявления которых манифестируют в течение раннего неонатального периода. При этом крайне важно проводить дифференциальную диагностику между внутриутробной инфекцией, которая развилась в результате интранатального инфицирования, и нозокомиальной инфекцией.
Следует отметить, что врождённую ВИЧ-инфекцию характеризует многолетнее латентное течение, а появление клинических симптомов обусловлено прогрессирующим снижением иммунитета, которое приводит к развитию тяжёлых форм оппортунистических заболеваний.
Установлено, что в подавляющем большинстве случаев врождённые инфекции различной этиологии у новорождённых имеют сходные клинические проявления. Наиболее типичные симптомы таких инфекций: ЗВУР; гепатоспленомегалия; желтуха; экзантемы; дыхательные расстройства; сердечно-сосудистая недостаточность; тяжёлые неврологические нарушения; тромбоцитопения, анемия и гипербилирубинемия с первых дней жизни.
Попытки установить этиологию врождённой инфекции только на основании клинических симптомов редко бывают удачными. Сопоставление клинических признаков врождённого сифилиса, токсоплазмоза, цитомегалии и краснухи приведено в табл. 6.
Таблица 6.
Клинические признаки TORCH-инфекции плода и новорождённого
|
Признаки |
Врождённый сифилис |
Токсоплазмоз (генерализованный) |
Синдром краснухи |
|
|
Тромбоцитопения | ||||
|
Гепатомегалия | ||||
|
Спленомегалия | ||||
|
Хориоретинит | ||||
|
Внутричерепные кальцификаты | ||||
|
Генерализованные отёки | ||||
|
Другие признаки |
Кожно-слизистые поражения, периостит, сопение, положительные серологические реакции |
Судороги, микроцефалия, гидроцефалия, лимфаденопатия |
Пневмония; клетки с цитомегаловирусными включениями в моче |
Катаракта, глаукома, поражения сердца, глухота, микроцефалия, гидроцефалия, поражения костей |
0 - признак не упоминается; + - признак присутствует в 1–25% случаев; ++ - признак присутствует в 26–50% случаев; +++ - признак присутствует в 51–75% случаев.
Лабораторная диагностика
Однотипность клинических проявлений врождённых инфекций обосновывает необходимость своевременного использования лабораторных методов установления этиологии ВУИ. При этом обследование новорождённых и детей первых месяцев жизни должно включать методы, направленные как на выявление возбудителя заболевания, его генома или Аг («прямые» методы диагностики), так и на обнаружение маркёров специфического иммунного ответа («непрямые» методы диагностики,). К «прямым» методам диагностики относят вирусологический, бактериологический и молекулярно-биологический методы (ПЦР, ДНК-гибридизация) и иммунофлюоресценцию. Из «непрямых» методов диагностики (на практике их, как правило, называют серологическими) наиболее широко используют ИФА, при помощи которого в сыворотке крови ребёнка определяют специфические АТ к Аг возбудителя. Для того чтобы получить достоверные результаты серологического обследования и адекватно трактовать эти данные, необходимо соблюдать определённые правила:
Серологическое обследование следует проводить до введения препаратов крови (плазмы, иммуноглобулинов и др.);
Серологическое обследование новорождённых и детей первых месяцев жизни следует проводить с одновременным серологическим обследованием матерей (для уточнения происхождения АТ: «материнские» или «собственные»);
Серологическое обследование следует проводить методом «парных сывороток» с интервалом в 2–3 нед. При этом исследование необходимо выполнять с использованием одной и той же методики в одной и той же лаборатории. Следует особо отметить, что в тех случаях, когда после первоначального серологического обследования ребёнку вводили препараты крови (иммуноглобулин, плазма и др.), исследование «парных сывороток» не проводят;
Оценку результатов серологических исследований проводят с учётом возможных особенностей характера и фазы иммунного ответа.
Особо следует подчеркнуть, что сероконверсия (появление специфических АТ у ранее серонегативного пациента или нарастание титров АТ в динамике), как правило, возникает позже дебюта клинических проявлений инфекции.
Таким образом, при наличии клинико-анамнестических данных, указывающих на вероятность ВУИ у новорождённого, верификацию заболевания необходимо проводить с использованием комплекса прямых и непрямых методов исследования. В практической неонатологии идентификация возбудителя может быть проведена любым из доступных методов. Однако следует помнить, что ни один лабораторный метод установления этиологии ВУИ не имеет абсолютной чувствительности и специфичности. Кроме того, на клиническую информативность лабораторных исследований существенно влияют условия забора, хранения и транспортировки биологического материала, что может быть причиной как ложноположительных, так и ложноотрицательных результатов, поэтому следует строго соблюдать все регламентирующие положения по проведению диагностических исследований. В целом «золотым стандартом» лабораторной верификации ВУИ следует считать комплекс, включающий обязательное использование «прямых» и «непрямых» методов диагностики.
В последнее время для выявления возбудителя в биологическом материале всё чаще используют ПЦР. Материалом может служить любая биологическая среда организма (пуповинная кровь, слюна, моча, смывы трахеи, ротоглотки, мазки с конъюнктивы, из уретры и т.д.). Если этиология заболевания связана с вирусными агентами, критерием активного периода ВУИ считают обнаружение возбудителя в крови или СМЖ (при поражении ЦНС). Если геном вируса обнаруживают в клетках других биологических сред, однозначно определить период заболевания очень трудно. В связи с высокой чувствительностью ПЦР к присутствию генома микроорганизмов, при нарушении правил забора биологического материала высока вероятность ложноположительного результата вследствие контаминации пробы микроорганизмами окружающей среды. Для исключения неправильной клинической интерпретации лабораторных данных, полученных методом ПЦР, в последние годы для целей клинической диагностики рекомендовано использование полуколичественных и количественных вариантов этого метода.
Выявление специфических IgM в пуповинной крови и в крови ребёнка первых недель жизни - один из важных критериев ВУИ. Подтверждением активного периода врождённой инфекции служит также выявление низкоавидных специфических АТ IgG с нарастанием их титров в динамике. При этом обязательно сопоставление полученных данных с результатами параллельного серологического обследования матери. Следует помнить, что выявление специфических IgM или повышение титра низкоавидных АТ в пуповинной крови свидетельствует о внутриутробном контакте плода с соответствующим микроорганизмом, но не доказывает того, что данный микроорганизм - причина инфекционного заболевания. Иными словами, на основании результата исследования можно утверждать лишь о внутриутробном инфицировании плода, но не обязательно о внутриутробной инфекционной болезни.
Для уточнения фазы и остроты инфекционного процесса показано проведение серологического исследования методом ИФА с количественным определением специфических АТ классов IgМ, IgG и оценкой уровня их авидности. Авидность - понятие, характеризующее скорость и прочность связывания Аг с АТ, косвенный признак функциональной активности АТ. В острый период развития инфекции сначала происходит образование специфических Ат к IgМ, затем - специфических низкоавидных АТ к IgG. Таким образом, их можно считать маркёром активного периода заболевания. По мере стихания остроты процесса авидность АТ к IgG нарастает, возникают высокоавидные иммуноглобулины, которые практически полностью заменяют синтез IgM. Таким образом, роль серологических маркёров острой фазы инфекционного процесса играют IgM и низкоавидные IgG. Некоторые авторы указывают также на способность возбудителей TORCH-группы подавлять иммунный ответ плода и новорождённого, что уменьшает диагностическую ценность серологических методов исследования. Изолированное выявление АТ класса IgG в сыворотке крови новорождённого без уточнения индекса авидности и без сопоставления с материнскими титрами не позволяет однозначно трактовать полученные данные, так как АТ могут иметь материнское происхождение (поступление в организм плода за счёт трансплацентарного их переноса). Только при динамическом (с интервалом в 14–21 день) сравнении уровней специфических АТ к IgG новорождённого и матери можно судить об их природе. Если титры специфических АТ к IgG у ребёнка при рождении равны материнским, а при повторном обследовании отмечают их снижение, то высока вероятность, что они имеют материнское происхождение.
Цитомегаловирусная инфекция
Примерно в 50% случаев инфицирование плода происходит от матери с первичной ЦМВИ, причём в 10% случаев речь идёт о рецидиве или обострении инфекции у матери во время беременности. Тяжёлые неврологические осложнения у детей возможны только при первичной ЦМВИ у матери. ЦМВИ, приобретённая во время родов, грудного вскармливания, после переливания препаратов крови и её компонентов, не приводит к тяжёлым неврологическим нарушениям у ребёнка. Вероятность того, что первичное инфицирование женщины, предрасположенной к ЦМВИ, произойдёт в течение данной беременности, составляет менее 1:100. Если беременная женщина всё же заболевает первичной ЦМВИ, то в каждом втором случае происходит инфицирование плода. Если у новорождённого выявлена врождённая ЦМВИ, вероятность неврологических осложнений составляет 1:14. Риск сероконверсии к ЦМВ во время беременности в среднем составляет 2–2,5%. Первичное инфицирование беременной приводит к трансмиссии (передаче) вируса плоду приблизительно в 40–50% случаев. Вероятность врождённой инфекции у детей от серопозитивных матерей составляет не более 0,2–1,5%. Предполагаемая частота клинически выраженной врождённой ЦМВИ в раннем неонатальном периоде составляет 2:1000.
Клинические проявления
В большинстве случаев инфекция протекает бессимптомно. Поздние проявления ЦМВИ (сенсорная глухота, трудности в обучении, минимальные мозговые дисфункции) развиваются в 10–15% случаев клинически невыраженной инфекции.
Синдром врождённой ЦМВИ (цитомегалия, инклюзионная болезнь) встречается редко. Для данного синдрома типична низкая масса тела при рождении, геморрагическая сыпь, тромбоцитопения, анемия, желтуха, гепатоспленомегалия, микроцефалия и хориоретинит. Более широко распространённым симптомокомплексом, выявляемым у новорождённых с ЦМВИ, считают сочетание низкой массы тела при рождении с гепатоспленомегалией и персистирующей желтухой.
Интранатальное или постнатальное заражение обычно приводит к латентной инфекции, которая клинически манифестирует на фоне снижения иммунитета. Инкубационный период составляет 3 нед и более. По истечении данного срока у новорождённого возможно возникновение гепатоспленомегалии, лимфаденопатии и пневмонии. При клиническом анализе крови выявляют атипичные лимфоциты. Тяжёлая интерстициальная пневмония или ЦМВИ в результате гемотрансфузии могут привести к летальному исходу у недоношенных новорождённых.
Диагностика
У детей, инфицированных антенатально, происходит выделение ЦМВ в высоких титрах с мочой и слюной, что позволяет легко и быстро обнаружить заболевание с помощью вирусологического исследования. Для выявления вируса необходимо собрать слюну в ёмкость с культуральной средой. Мочу и другие биологические жидкости посылают в лабораторию на льду (при температуре 0–4 °С). Замораживание собранного материала приводит к инактивации вируса. Диагностическое значение имеет также определение специфических IgM к ЦМВ в сыворотке пуповинной и периферической крови новорождённого с помощью ИФА. Частицы вируса могут быть обнаружены при электронной микроскопии слюны, осадка мочи или биоптата печени. При цитологическом исследовании осадка мочи или тканей печени в ряде случаев можно определить типичные гигантские клетки с включениями («совиный глаз»). Для обнаружения ДНК вируса используют ПЦР. Наличие стабильных высоких титров специфических анти-цитомегаловирусных АТ класса IgG в возрасте 6–12 нед ретроспективно подтверждает диагноз врождённой ЦМВИ. Для установления степени тяжести ЦМВИ необходимо провести дополнительные диагностические исследования, включающие НСГ, рентгенографию черепа или КТ (для выявления внутричерепных кальцификатов), рентгенографию трубчатых костей и грудной клетки, биохимическое исследование функций печени.
Лечение и профилактика
В последние годы для лечения тяжёлых форм врождённой ЦМВИ в ряде стран с определённым успехом используют ганцикловир. Однако, в связи с отсутствием регистрационного разрешения Фармкомитета РФ на использование этого препарата у детей раннего возраста, специфическую противовирусную химиотерапию врождённой ЦМВИ в нашей стране не применяют. Для уменьшения виремии можно использовать препараты иммуноглобулина для внутривенного введения (специфический антицитомегаловирусный или поливалентные иммуноглобулины). При этом режим дозирования специфического антицитомегаловирусного иммуноглобулина для внутривенного введения (НеоЦитотект) составляет 1 мл/кг (100 МЕ/кг) с интервалом 48 ч. В течение первых 10 мин введения скорость инфузии не должна превышать 0,08 мл/(кгxч). При отсутствии клинических проявлений анафилаксии скорость введения постепенно увеличивают до 0,8 мл/(кгxч). Кратность введения при этом зависит от динамики регресса клинических проявлений инфекции и составляет обычно не менее 3–5 инфузий. В настоящее время проводят исследования по оценке клинической эффективности лечения врождённой ЦМВИ препаратами альфа-интерферонов. В связи отсутствием данных о сравнительных многоцентровых исследованиях, рекомендации по использованию для лечения заболевания отечественного препарата интерферона альфа-2 следует рассматривать как предварительные, а само лечение - как вспомогательное.
Поскольку при врождённой неонатальной ЦМВИ возможно развитие глухоты, показано исследование состояния органа слуха у больных детей методом слуховых вызванных потенциалов. Дети с врождённой ЦМВИ могут являться источником заражения для окружающих. Не рекомендуется допускать к уходу за больными детьми беременных женщин. В настоящее время идёт разработка живой противовирусной вакцины.
Герпетическая инфекция
В развитии неонатального герпеса играют роль два серотипа вируса простого герпеса. У новорождённых тяжёлое генерализованное заболевание с высоким уровнем летальности чаще вызывает вирус простого герпеса 2-го типа. Вместе с тем, изолированные герпетические энцефалиты чаще обусловлены вирусом простого герпеса 1-го типа. Риск герпетической инфекции у ребёнка при родах через естественные родовые пути матери с первичной генитальной инфекцией составляет 33–50%. Риск для ребёнка, рождённого матерью, выделяющей вирус простого герпеса в результате реактивированной инфекции, значительно ниже - до 5%. Трансплацентарное заражение, приводящее к самопроизвольному прерыванию беременности или врождённым порокам развития, встречается редко. Чаще заражение происходит в процессе родов при контакте с выделениями из половых путей матери. В связи с этим основное значение имеет возникновение или обострение генитального герпеса у матери на последнем месяце беременности. В этом случае возможно инфицирование восходящим путём при преждевременном излитии околоплодных вод. Трансмиссивная передача происходит также при нарушении целостности кожного покрова плода. Операция кесарева сечения, проведённая не позже чем через 4 ч после разрыва околоплодных оболочек, уменьшает риск заболевания новорождённого в 10 раз. Частота возникновения ВУИ, вызванной вирусом простого герпеса 1-го и 2-го типов, неизвестна. Предполагаемая заболеваемость в России - 1 случай на 2000–3000 живорождённых.
Клинические проявления
Бессимптомное течение инфекции встречается редко. Герпетическое поражение бывает локализованным или генерализованным. Среди локализованных форм выделяют герпетическое поражение кожи или глаз. Генерализованная инфекция манифестирует признаками, характерными для сепсиса. Изолированное поражение ЦНС (герпетический менингоэнцефалит) протекает с лихорадкой, вялостью, плохим аппетитом, гипогликемией, ДВС-синдромом или синдромом повышенной нервно-рефлекторной возбудимости, за которым следуют купируемые с трудом судороги. Важный симптом заболевания - типичные везикулёзные элементы, выявляемые при осмотре кожи и слизистых ротовой полости.
Методы диагностики
Для выявления герпетической инфекции используют следующие методы:
Соскоб стенки везикул, повреждённых участков кожи и слизистых оболочек исследуют с помощью микроскопии (в мазке по Тцанку выявляются гигантские многоядерные клетки) или прямым иммунофлюоресцентным методом для обнаружения Аг вируса простого герпеса;
Исследование крови, СМЖ, содержимого везикул, а также мазков из зева и глаз;
Обследование матери на наличие вагинальных, цервикальных или других герпетических повреждений (посевы следует проводить даже при отсутствии клинической картины);
При возникновении у новорождённого генерализованной инфекции неясной этиологии, когда нет эффекта от целенаправленной антибактериальной терапии, необходима дифференциальная диагностика между сепсисом и генерализованной герпетической инфекцией.
Определение содержания противогерпетических АТ у матери не имеет диагностического и прогностического значения при определении риска развития инфекции у новорождённого.
Лечение и профилактика
Наиболее эффективным методом профилактики герпетической инфекции у новорождённых, у матерей которых в III триместре беременности выявлен генитальный герпес, считают родоразрешение путём операции кесарева сечения до момента разрыва околоплодных оболочек. В случае преждевременного разрыва околоплодных оболочек данная операция эффективна, если выполнена не позднее чем через 4 ч после излития околоплодных вод. Ребёнка с любой формой герпетической инфекции или с подозрением на герпес необходимо изолировать от других новорождённых.
Учитывая тяжёлые последствия герпетической инфекции, во всех случаях подозрения на неонатальный герпес, а также при высоком риске его развития у новорождённого (рождение через естественные родовые пути женщины с генитальным герпесом, выявленным во время родов или за несколько недель до них) есть основания для начала противовирусной терапии ацикловиром. При всех клинических формах герпетической инфекции у новорождённого, включая изолированные поражения кожи, противовирусная терапия ацикловиром показана в обязательном порядке. Доза препарата и длительность лечения зависит от клинической формы заболевания, а также (в сомнительных случаях) от результатов лабораторного и инструментального обследования ребёнка.
Согласно рекомендациям Российской ассоциации специалистов перинатальной медицины (2002), при изолированном поражении кожи ацикловир применяют в дозе 45 мг/(кгxсут), разделённой на 3 введения (по 15 мг/кг каждые 8 ч) в виде медленной инфузии в течение 10–14 дней. Многоцентровые исследования, проведённые в последние годы, доказывают целесообразность использования при локализованном герпесе такой же дозы, как и при генерализованной форме. При генерализованной форме, герпетическом поражении ЦНС или офтальмогерпесе дозу ацикловира увеличивают до 60 мг/(кгxсут) (по 20 мг/кг каждые 8 ч). Длительность лечения составляет 14–21 день. При офтальмогерпесе одновременно с парентеральным введением целесообразно использовать глазную мазь, содержащую ацикловир.
Токсоплазмоз
Клинические проявления
Классическая триада в виде гидроцефалии, хориоретинита и внутричерепных кальцификатов возможна у новорождённых, инфицированных в I триместре беременности. У некоторых новорождённых возникает клиническая картина сепсиса. Новорождённые, инфицированные в конце беременности, при рождении обычно не имеют клинических признаков заболевания.
Диагностика
Для постановки диагноза применяют следующие серологические методы обследования:
ИФА - легкодоступный и наиболее часто используемый тест;
Методом ИФА выявляют специфические IgM, ранние АТ в острой фазе инфекции. Методика редко применяется ввиду её технической сложности, кроме того, у некоторых внутриутробно инфицированных новорождённых наблюдают недостаток выработки АТ к IgM.
Лечение
Оправдала себя схема применения препаратов циклами: пириметамин - 5 дней, сульфаниламид - 7 дней. Проводят 3 цикла с интервалами 7–14 дней. Такой курс терапии по показаниям (хроническая форма при иммунодефицитном состоянии, обострение хориоретинита и пр.) повторяют через 1–2 мес, при непереносимости сульфаниламидов возможна терапия пириметамином в комбинации с клиндамицином по 10–40 мг/(кгxсут) в 3 введения.
Хламидийная инфекция
Клинические проявления.
При остром течении внутриутробного хламидиоза возможно развитие конъюнктивита, пневмонии, бронхита, назофарингита, отита, сепсиса, менингоэнцефалита, уретрита, цервицита, вульвовагинита, энтероколита, реактивного артрита, кардита. Наибольшее значение в патологии новорожденных, инфицированных хламидиями, имеют офтальмохламидиоз и хламидийная пневмония.
При латентной дремлющей инфекции нет постоянного размножения возбудителя, но оно начинается в условиях сниженной иммунной защиты, что может вести к проявлению симптомов заболевания через несколько дней и недель жизни. Латентное течение хламидийной инфекции у ребенка не исключает возможность репродукции хламидий в клетках и тканях центральной нервной системы и экстраневрально, следствием чего может явиться развитие астеновегетативного синдрома, судорожных и ликвородинамических нарушений. Поздняя диагностика и отсутствие ранней специфической терапии ведет к развитию хронических форм заболевания. Формирование латентной или персистирующей инфекции способствует развитию вторичного иммунодефицита и аутоиммунных заболеваний. Особенностью хламидиоза является отсутствие патогномоничных признаков и неспецифичность клинической симптоматики в периоде новорожденности. Хламидийная инфекция осложняет адаптацию новорожденных и проявляется неврологическими нарушениями, дыхательными расстройствами, отёчным и геморрагическим синдромами, офтальмопатией, длительной и выраженной желтухой, замедленной потерей и восстановлением массы тела после рождения. Иногда хламидиоз проходит под диагнозами "внутриутробная гипоксия" и родовая травма. Наиболее характерными являются церебральные расстройства. Уже в первые часы жизни появляются неврологические нарушения в виде синдромов нервно-рефлекторной возбудимости или угнетения функции ЦНС. Нарушения неврологического статуса в большинстве случаев имеют стойкий характер. Отмечены повышенное беспокойство, расстройство сна, повышенная реактивность, изменение мышечного тонуса, угнетение физиологических рефлексов, тремор конечностей. Дети склонны к быстрому охлаждению или перегреванию, у них длительно сохраняются локальный цианоз, мраморность кожи.
Лечение
Изучение микробиологических особенностей хламидий (с внутриклеточным циклом развития) объясняют неэффективность бета-лактамных антибиотиков и обусловливают применение антибактериальных препаратов, способных проникнуть и накапливаться в пораженных клетках и межклеточных пространствах. Данными свойствами обладают макролиды, тетрациклины фторхинолоны, которые и являются средствами эрадикационной терапии при хламидийной инфекции.
Макролиды имеют основное клиническое значение в отношении грамположительных кокков и внутриклеточных возбудителей, оказывая бактериостатическое действие. Они являются на сегодняшний день единственной группой антибиотиков, истинная резистентность к которой у патогенных для человека хламидий практически не встречается. Наиболее широко используют три группы макролидов:
I группа – 14 –членные (эритромицин, кларитромицин, рокситромицин);
II группа – 15 –членные (азитромицин);
III группа – 16 –членные (джозамицин, спирамицин, мидекамицин).
Одним из иммуномодулирующих препаратов является Генферон- Лайт -комбинированный препарат, действие которого обусловлено компонентами, входящими в его состав. Оказывает местное и системное действие.
В состав препарата Генферон- Лайт входит рекомбинантный человеческий интерферон альфа-2b, вырабатываемый штаммом бактерии Escherichia coli, в которую методами генной инженерии введён ген интерферона альфа-2b человека.
Таурин способствует нормализации метаболических процессов и регенерации тканей, обладает мемраностабилизирующим и иммуномодулирующим действием. Являясь сильным антиоксидантом, таурин непосредственно взаимодействует с активными формами кислорода, избыточное накопление которых способствует развитию патологических процессов. Таурин способствует сохранению биологической активности интерферона, усиливая терапевтический эффект применения препарата.
При ректальном введении препарата отмечается высокая биодоступность (более 80%) интерферона, в связи с чем достигается как местное, так и выраженное системное иммуномодулирующее действие; при интравагинальном применении за счёт высокой концентрации в очаге инфекции и фиксации на клетках слизистой оболочки достигается выраженный местный противовирусный, антипролиферативный и антибактериальный эффект, при этом системное действие за счёт низкой всасывающей способности часов после введения препарата. Основным путём введения ά- интерферона является почечный катаболизм. Период полувыведения составляет 12 часов, что обусловливает необходимость применения препарата 2 раза в сутки.
Назначается Генферон- Лайт по 1 суппозиторию 2 раза в сутки через 12 часов. Курс лечения составляет 5 дней, при необходимости добавляется этиотропная терапия (антибиотик и/или симптоматические средства).
5. НЕДОНОШЕННЫЕ НОВОРОЖДЕННЫЕ ДЕТИ: АНАТОМО-ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ, ВЫХАЖИВАНИЕ, ВСКАРМЛИВАНИЕ
Преждевременные роды (рождение недоношенного ребенка) - это роды, происшедшие до окончания полных 37 недель беременности. Срок беременности (срок гестации) условно отсчитывают с первого дня последнего менструального цикла. Может использоваться термин «постконцептуальный возраст» - предполагаемый общий (т.е. гестационный плюс постнатальный) возраст недоношенного ребенка в неделях с начала последнего менструального цикла матери. Учреждения здравоохранения должны осуществлять регистрацию всех детей, родившихся живыми и мертвыми, которые имеют массу тела при рождении 500 г и более, длину - 25 см и более, при сроке беременности 22 нед. и более. Однако по-прежнему государственная статистика из рожденных живыми учитывает только детей с 28 нед. гестации и более (масса тела 1000 г и более, длина 35 см и более). Из родившихся живыми с массой тела 500-999 г подлежат регистрации в органах ЗАГСа только те новорожденные, которые прожили 168 часов (7 суток).
Согласно приказу Минздрава России №318 от 04.12.92 рекомендована следующая терминология: все дети с массой тела <2500 г - это новорожденные с малой массой.
Среди них выделяют группы:
2500- 1500 г - дети с низкой массой тела при рождении (НМТ);
1500- 1000 г-с очень низкой массой тела (ОНМТ);
1000 г - с экстремально-низкой массой тела (ЭНМТ).
В международной классификации болезней Х пересмотра, принятой на 43-й Всемирной ассамблее здравоохранения (1993) включены рубрики, отражающие расстройства, связанные с длительностью беременности и ростом плода:
Р05 Замедленный рост и недостаточность питания плода;
Р07 Расстройства, связанные с укороченным сроком беременности и с низким весом при рождении.
Масса тела не может быть основным критерием недоношенности, т.к. среди детей с массой тела менее 2500 г около 30 % составляют доношенные дети (со ЗВУР).
На основании данных массы и длины тела, а также окружности головы выделяют следующие категории новорожденных детей:
маленькие к гестационному возрасту («small for date») – дети с задержкой внутриутробного роста и развития (ЗВУР);
соответствующие гестационному возрасту;
большие к гестационному возрасту.
Таблица 6.
Классификация детей по степени недоношенности в зависимости от срока гестации
В настоящее время при установлении диагноза «недоношенный новорожденный» указывается срок беременности в неделях, на котором произошли данные роды (гестационный возраст новорожденного). Это конкретизирует базовую ситуацию, позволяет дать правильную оценку недоношенного ребенка и выбрать тактику его ведения (пример диагноза: недоношенный новорожденный - 28 недель).
Причины недонашивания беременности.
TORCH синдром ставят, когда нет точного этиологического диагноза, не знают какая именно внутриутробная инфекция плода является диагнозом. Диагностика ВУИ очень сложна. Нужно обследовать не только ребенка, но и мать, а также послед и пуповину. Непрямой метод диагностики - анализ крови методом ИФА на инфекции. Однако даже если у ребенка обнаруживаются антитела к какой-либо инфекции, это не всегда свидетельство ВУИ. Ведь они могли быть занесены в организм ребенка от матери. Тогда у ребенка повторно берут анализ крови через 3-4 месяца, и если титр антител увеличился в 4 и более раз - это считается диагностически значимым признаком.
Причины внутриутробных инфекций при беременности - это, как правило, заражение данными заболеваниями матери. Заражение плода происходит чаще именно в случае первой встречи организма матери в инфекционными возбудителями.
В свою очередь диагностика внутриутробных инфекций при беременности практически невозможна. Есть только признаки, по которым можно заподозрить неблагополучие у ребенка. В том числе их определяют при помощи ультразвукового исследования.
Некоторые симптомы внутриутробной инфекции при беременности, на которые врачи обращают внимание:
- задержка развития плода (определяется путем измерения длины матки - при задержке развития она растет медленно, и по данным УЗИ о размерах головы, конечностей, объеме туловища);
- многоводие или маловодие;
- патологии плаценты;
- поликистоз легких;
- гидроцефалия и пр.
Чем опасна внутриутробная инфекция при беременности знают многие женщины, потерявшие своих детей незадолго до родов или в течение нескольких дней после рождения. Именно ВУИ - самая распространенная причина ранней детской смертности. Примерно у 80% детей, родившихся с пороками развития, определяют ВУИ.
Последствия внутриутробных инфекций при беременности у родившегося ребенка могут выражаться в нарушениях дыхательной функции, сердечно-сосудистой патологии, желтухе, лихорадочных состояниях, поражениях глаз, слизистых оболочек, энцефалите и т. д.
Заражение может произойти следующими путями:
- через кровь, плаценту, таким образом очень легко проникает в организм ребенка, например, токсоплазма - возбудитель токсоплазмоза;
- из половых путей, так бывает при таких инфекциях, как герпес при беременности , микоплазмоз, хламидиоз и др., то есть тех, которые передаются половым путем, проявляются именно поражением половых органов;
- из маточных труб;
- при рождении ребенка естественным способом.
Профилактика
Каждая женщина, планирующая беременность, должна еще до ее наступления пройти общее обследование для обнаружения возможных инфекций (они могут протекать и бессимптомно) и лечения при необходимости. Во время же беременности нужно соблюдать все известные меры профилактики для снижения риска заражения различными инфекциями. Мы приведем несколько таких мер.
1. Убирать туалет животных только защищенными перчатками руками, мыть руки. Обязательно тщательно готовить мясо, хорошо проваривать. Иначе можно заразиться токсоплазмозом - очень опасной для ребенка инфекцией.
2. Не бывать в детских коллективах, если нет прививки от краснухи, и она не была перенесена ранее. Если женщина в первом триместре беременности заболевает краснухой, ей рекомендуется сделать аборт, так как данное заболевание почти всегда вызывает тяжелые пороки развития у плода, формирование органов которого только началось.
3. Не ездить в общественном транспорте, не ходить без маски в период гриппа. Любое ОРВИ и ОРЗ, при тяжелом течении, может убить ребенка. Не выходите «в люди» без особой нужды. А если выходите, то обязательно смазывайте нос оксолиновой мазью и надевайте медицинскую маску. Немытыми руками не прикасайтесь к лицу. Тщательно мойте руки антибактериальным мылом после посещения поликлиник, больниц, магазинов, общественного транспорта.
4. Если герпес (простуда) появилась на губах - инфекция может быть легко перенесена на половые органы самой же будущей мамой. А генитальный герпес, да еще и при первых проявлениях во время беременности, почти всегда очень влияет на здоровье будущего ребенка.
Это часть мер, которая гарантированно убережет вас и вашего ребенка от некоторых опасных инфекционных болезней.
ВУИ - одна из ведущих причин перинатальной заболеваемости и смертности. Частота ВУИ варьирует в больших пределах и зависит от многих факторов: вида возбудителя, состояния плода и новорожденного, срока гестации и др. В настоящее время частота различных проявлений ВУИ составляет 10-53% (рис. 102).
Рис. 102. Различные проявления ВУИ
Различают два понятия: собственно ВУИ и внутриутробное инфицирование.
ВУИ - это заболевание, при котором источником заражения плода является организм инфицированной матери и которое имеет разнообразные клинические проявления в виде пиодермии, конъюнктивита, ринита, гепатита, гастроэнтерита, пневмонии, отита, менингоэнцефалита, даже сепсиса. Инфицирование же не имеет клинических проявлений у плода и выражается лишь в проникновении в его организм возбудите-
ля. Заболевание у плода не возникает в результате мобилизации иммунитета и защитных механизмов в системе мать-плод. В обоих случаях заражение происходит в антенатальном периоде или в родах.
этиология внутриутробных инфекций
Известна акушерская аксиома: нет параллелизма между тяжестью инфекционного процесса у матери и у плода. Легкая, малоили даже бессимптомная инфекция у беременной может привести к тяжелым поражениям плода вплоть до его инвалидизации или даже гибели. Данный феномен в значительной степени обусловлен тропизмом возбудителей (особенно вирусных) к определенным эмбриональным тканям, а также тем, что клетки плода с их высочайшим уровнем метаболизма и энергетики - идеальная среда для размножения (репликации) микробов. Именно этим и объясняется большое сходство эмбрио- и фетопатий, вызванных различными инфекционными агентами.
Для обозначения группы ВУИ была предложена аббревиатура TORCH (по первым буквам названий инфекций, однако слово «torch» несет в себе больший смысл - с английского языка оно переводится как «факел», что подчеркивает опасность и тяжелые последствия ВУИ).
Аббревиатура TORCH расшифровывается следующим образом. Toxoplasmosis - токсоплазмоз.
Others - другие инфекции (абсолютно доказано: ВУИ вызывают возбудители сифилиса, хламидиоза, энтеровирусных инфекций, гепатитов А и В, гонококковой инфекции, листериоза; вероятными виновниками ВУИ считаются возбудители кори и эпидемического паротита; гипотетическими - возбудители гриппа А, лимфоцитарного хориоменингита, вирус папилломы человека).
Rubeola - краснуха.
Cytomegalia - цитомегаловирусная инфекция. Herpes - герпесвирусная инфекция.
Перечисленные инфекции наиболее широко распространены среди взрослого населения, в том числе и у беременных женщин.
Токсоплазмоз отмечается у 5-7% беременных, при этом в 30% случаев возможно заражение плода (энцефалит и его последствия, хориоретинит, генерализованный процесс, сопровождающийся гепатоспленомегалией, желтухой и поражением сердечно-сосудистой системы).
Заражение плода сифилисом происходит на 6-7 мес беременности, спирохеты могут проникать через неповрежденную плаценту. В результате наступает выкидыш мацерированным плодом или рождение мертвого ребенка с признаками висцерального сифилиса (поражение печени, интерстициальная пневмония, остеомиелит, остеохондрит).
Во время беременности хламидии выявляют в 12,3% случаев, около 50% детей, рожденных от матерей с хроническим эндоцервицитом, имеют признаки хламидийной инфекции.
Достаточно распространены энтеровирусные инфекции. В качестве возбудителей ВУИ наибольший интерес представляют вирусы ЕСНО и Коксаки. Энтеровирусы передаются беременным при прямом контакте с больными, у которых отмечаются поражения верхних дыхательных путей, легких или проявления кишечной инфекции. В эксперименте доказана этиологическая роль вирусов Коксаки группы А (серотипы 3, 6, 7, 13) и группы В (серотипы 3,4), а также вирусов ЕСНО (серотипы 9 и 11).
До 1% беременных являются носительницами австралийского (HBsAg) антигена, при этом риск инфицирования плода и новорожденного составляет 10%.
Перинатальное инфицирование листериозом происходит трансплацентарно, реже восходящим путем и через амниотическую жидкость при листериозном пиелите, эндоцервиците или гриппоподобном заболевании; ребенок обычно рождается с генерализованной формой инфекции (гранулематозный сепсис).
Корь относится к числу наиболее распространенных инфекций и встречается в 0,4-0,6 случая на 10 тыс. беременностей.
Вирус краснухи способен проникать через плацентарный барьер. Вероятность инфицирования плода зависит от срока беременности и составляет 80% в первые 12 нед, 54% - в 13-14 нед и не более 25% - к концу II триместра.
Цитомегаловирус - частая причина ВУИ (внутриутробное инфицирование - в 10% случаев). Риск инфицирования плода при рецидивирующей цитомегаловирусной инфекции у беременной невелик ввиду того, что плод защищен циркулирующими в крови матери антителами. Следовательно, группу риска врожденной цитомегалии составляют дети серонегативных матерей с сероконверсией, произошедшей во время данной беременности.
Поражение вирусом генитального герпеса выявляется у 7% беременных. Герпетическая инфекция характеризуется пожизненным носительством вируса.
Особая актуальность герпетической инфекции связана с появлением больных СПИДом. Установлено, что вирусы герпеса могут активировать геном ВИЧ, находящийся в стадии провируса, и являются кофактором прогрессирования ВИЧ-инфекции. До 50% детей, рожденных от инфицированных ВИЧ матерей, заражаются антенатально, интранатально или в раннем неонатальном периоде через молоко матери.
ОРВИ, перенесенная во второй половине беременности, представляет собой фактор риска развития ВУИ вследствие трансплацентарной передачи вируса плоду. Респираторные вирусы, вызывающие перинатальные повреждения в 11% случаев, могут сохраняться и размножаться в плаценте, головном мозге плода и особенно в сосудистых сплетениях боковых желудочков мозга.
патогенез внутриутробных инфекций
Патогенез ВУИ разнообразен и зависит от многих факторов, прежде всего от течения инфекционного процесса у матери (острое, латентное, стадия ремиссии или обострения, носительство). При инфекционном заболевании у матери во время беременности на эмбрион и плод воздействуют не только возбудители, но и токсичные продукты, образующиеся при нарушении метаболизма у матери, при распаде инфекционного агента, и, кроме того, гипертермия и гипоксия, имеющие место при остром процессе.
Важную роль в патогенезе играет срок гестации. В предимплантационный период (первые шесть дней после оплодотворения) под влиянием возбудителя инфекции зигота гибнет или полностью регенерирует. В период эмбрио- и плацентогенеза (с 7-го дня до 8-й нед) возможны ги-
бель эмбриона, развитие уродств, первичной плацентарной недостаточности. В раннем фетальном периоде (с 9-10 до 28 нед) плод и плацента приобретают чувствительность к возбудителю. Возможно развитие уродств (так называемые псевдоуродства), а также склеротических изменений в органах и тканях.
ВУИ приводит к нарушению дальнейшего развития уже сформированного органа. Так, инфекция мочевыводящих путей может привести к гидронефрозу, менингоэнцефалит - к гидроцефалии на фоне сужения или облитерации сильвиева водопровода мозга. После 28-й недели гестации плод приобретает способность специфически отвечать на внедрение возбудителя инфекции лейкоцитарной инфильтрацией, гуморальными и тканевыми изменениями.
Исход внутриутробной инфекции может быть различным: недонашивание, внутриутробная задержка роста, антенатальная гибель или различные проявления локального и генерализованного инфекционного процесса, плацентарная недостаточность, нарушения адаптации новорожденного; клинические проявления ВУИ могут отмечаться в первые дни жизни (в первые четыре дня, а при некоторых видах специфической инфекции - после 7-го дня и далее).
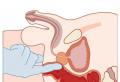
Локализация инфекционного процесса у плода и новорожденного зависит от пути проникновения возбудителя. Классическими считаются четыре пути внутриутробного инфицирования: восходящий путь - через родовые пути (бактериальная и урогенитальная инфекция); трансплацентарный (гематогенный) путь (бактериальные очаги воспаления; вирусные инфекции; листериоз; сифилис; токсоплазмоз); нисходящий путь (при воспалительных процессах в органах брюшной полости); смешанный путь.
Бактериальная ВУИ развивается в основном вследствие проникновения восходящей инфекции из родовых путей, причем сначала возникает хориоамнионит, инфицируются околоплодные воды, а плод поражается вследствие заглатывания околоплодных вод или попадания их в дыхательные пути. Возможно инфицирование при прохождении плода через родовой канал, что характерно для бактериальной и урогенитальной инфекции. При гематогенном инфицировании плода должен быть гнойно-воспалительный очаг в организме матери. Возбудитель поражает плодовую часть плаценты, нарушая плацентарный барьер, проникает
в кровоток плода. При гематогенном инфицировании нередко возникает генерализованное поражение организма плода - внутриутробный сепсис. Для всех истинных врожденных вирусных инфекций характерен трансплацентарный путь инфицирования, в том числе для таких специфических, как листериоз, сифилис, токсоплазмоз и цитомегаловирусная инфекция. Трансдецидуальный (трансмуральный), нисходящий и смешанный пути инфицирования наблюдаются значительно реже, патогенез поражения плода при этом не отличается от такового при гематогенном и восходящем инфицировании.
клиническая картина
Клинические проявления ВУИ носят в основном неспецифический характер и зависят от срока гестации при инфицировании, численности и вирулентности возбудителей, пути инфицирования.
Отмечено, что чем меньше срок гестации при инфицировании, тем тяжелее течение и хуже прогноз ВУИ. Наиболее выраженные повреждения печени и головного мозга, носящие диссеминированный характер, вызывают возбудители, проникающие к плоду трансплацентарно. Клинически это проявляется самопроизвольным абортом, гибелью плодного яйца, преждевременными родами, задержкой развития плода, аномалиями его развития и рождением больного ребенка. Подобные поражения характерны для: кори, краснухи, ветряной оспы, цитомегалии, эпидемического паротита, гриппа, парагриппа, простого герпеса II типа, Коксаки, парвовируса В19 (в ранние сроки беременности), а также ВИЧ-инфекции и некоторых бактериальных инфекций (листериоз, стрептококковая инфекция).
При инфицировании в I триместре беременности у плода могут развиться микро- и гидроцефалия, внутричерепной кальциноз, пороки развития сердца и конечностей, во II и III триместрах - хориоретинит, гепатоспленомегалия и желтуха, пневмония, гипотрофия.
Восходящий путь инфицирования характерен для условно-патогенных микроорганизмов, гарднерелл, простейших, грибов, хламидий, микоплазм и др. Возбудители размножаются и накапливаются в околоплодных водах, что клинически проявляется синдромом «инфицированности» или «инфекции околоплодных вод». Во время беременности при такой инфекции отмечаются многоводие, гипотрофия и
гипоксия плода, отечный синдром, увеличение у плода печени и селезенки, гипербилирубинемия; возможно невынашивание беременности, преждевременные роды.
В то же время не исключается асимптомная колонизация околоплодных вод различными микроорганизмами. Бессимптомный хориоамнионит следует предполагать, если при угрожающих преждевременных родах лечение токолитиками безуспешно.
К неспецифическим клиническим проявлениям ВУИ у новорожденных можно отнести респираторный дистресс-синдром, признаки асфиксии, болезнь гиалиновых мембран, врожденную гипотрофию, желтуху, отечный синдром, ДВС-синдром, а также симптомокомплекс, требующий тщательной дифференциальной диагностики с проявлениями повреждений ЦНС гипоксически-травматического генеза (общая вялость, снижение мышечного тонуса и рефлексов, срыгивание, отказ от груди, интенсивное снижение массы тела и медленное ее восстановление, нарушения дыхания, приступы цианоза).
У части новорожденных проявления ВУИ носят иной, специфический характер: везикулопустулез при рождении, конъюнктивит, отит, внутриутробная пневмония, энтероколит, менингоэнцефалит, гастроинтестинальный синдром.
Следует отметить возможность развития ВУИ у детей в отдаленном периоде развития, связанную с персистенцией вируса (хламидийный конъюнктивит, прогрессирующая катаракта при инфицировании вирусом краснухи, гидроцефалия при персистенции вирусов Коксаки, хронический пиелонефрит и ювенильный сахарный диабет при хронической врожденной энтеровирусной инфекции).
Особенности клинических проявлений отдельных заболеваний у беременных
Грипп. При заболевании гриппом в I триместре выкидыши отмечаются в 25-50% случаев. Однако частота пороков развития плода не увеличена.
Краснуха. Инфекция плода возникает у женщин, впервые заболевших краснухой во время беременности. Инфицирование плода в первые 12 нед эмбриогенеза приводит к развитию наследственного синдрома краснухи (катаракта, микрофтальмия, нарушение функции органов слуха, микро- и гидроцефалия и пороки сердца). При заболевании в I триместре беременности риск выкидышей и врожденных аномалий разви-
тия достаточно высок, поэтому беременность следует прервать. При инфицировании на более поздних сроках чаще всего поражается орган слуха. После 16 нед гестации риск инфицирования уменьшается, но инфекция в эти сроки может привести к развитию хронического заболевания с нарушением функции печени, анемией, тромбоцитопенией, поражением ЦНС, иммунодефицитом, дисплазией зубов. Параллельно поражается плацента (воспаление ворсин и васкулит), что нарушает питание плода. Риск поражения плода вирусом краснухи зависит от срока беременности, на котором произошло инфицирование матери (табл. 24).
Корь. Увеличен риск прерывания беременности (так же как при гриппе), но аномалий развития плода не отмечается.
Полиомиелит. При беременности увеличены риск заболевания и его тяжесть. До 25% плодов у заболевших матерей переносят полиомиелит внутриутробно. Аномалий развития плода этот вирус не вызывает.
Паротит. Характерны низкая заболеваемость и смертность. Протекает в легкой форме. Риск аномалий развития отсутствует.
Гепатит А (РНК-вирус). Орально-фекальный путь заражения. При беременности практически не бывает осложнений, если заболевание протекает в легкой форме.
Гепатит В (ДНК-вирус). Пути заражения - парентеральный, перинатальный и половой. До 10-15% населения являются хроническими носителями вируса гепатита В. Беременная заражает плод в процессе родов (использование головки плода для мониторного контроля в родах не рекомендуется).
Парвовирус. ДНК-вирус при беременности проходит через плаценту, вызывая у плода неиммунный отечный синдром. Клиническая картина у матери характеризуется наличием сыпи, артралгии, артрозов, транзиторной апластической анемии. У 50% женщин имеются антитела против парвовируса. Если у беременной нет антител, то наибольший риск прерывания беременности отмечается в срок до 20 нед. Заражение плода происходит в фазу вирусемии. Вирус имеет тропизм к клеткам-предшественникам эритроцитов. Клинические проявления ВУИ зависят от срока гестации: ранний срок беременности - спонтанный аборт, поздний - неиммунная водянка плода как проявление тяжелой формы гемолитической анемии, внутриутробная гибель плода; развивающийся у плода отечный синдром возникает за счет сердечной недостаточности, обусловленной анемией. Неблагоприятный исход наблюдается в 20-30% случаев. В 70-80% случаев серологически подтвержденной инфекции у матери повреждающего действия на плод не отмечается, что можно объяснить нейтрализацией вируса антителами. Специфической терапии нет.
Герпес. Наибольшую роль в патологии беременности и внутриутробной инфекции для плода играют вирусы семейства Herpesviridae.
Вирусы герпеса передаются различными путями, но наибольшее значение имеет половой путь инфицирования. Первичный генитальный герпес у матери и обострение хронического наиболее опасны для плода. Если интранатально инфицируются 0,5-1% новорожденных детей, то при остром генитальном герпесе и обострении хронического (что проявляется пузырьковыми поражениями кожи и слизистых оболочек гениталий) риск инфицирования плода в родах достигает 40%. Неблагоприятные исходы для плода в основном связаны с трансплацентарным (гематогенным) путем передачи возбудителя.
Инфицирование плода в I триместре беременности приводит к возникновению гидроцефалии, пороков сердца, аномалий развития желудочно-кишечного тракта и др. Часто отмечается самопроизвольное прерывание беременности. Инфицирование во II и III триместрах чревато развитием у плода гепатоспленомегалии, анемии, желтухи, пневмонии, менингоэнцефалита, сепсиса, гипотрофии. При восходящем пути инфицирования (из шейки матки) возбудитель размножается и накапливается в околоплодных водах, отмечается многоводие. Возможно и постнатальное инфицирование новорожденных при наличии герпетических проявлений на коже у матери, родственников или медицинского персонала.
Так, инфицирование плода до 20 нед гестации приводит к спонтанному аборту или аномалиям развития плода в 34% случаев, в сроки от 20 до 32 нед - к преждевременным родам или антенатальной гибели плода в 30-40% случаев, после 32 нед - к рождению больного ребенка с поражением кожи (герпетические высыпания, изъязвления, встречающиеся достаточно редко), глаз (катаракта, микрофтальмия, хориоретинит) и ЦНС (микроили гидроцефалия, церебральные некрозы). Следует отметить тяжесть проявлений заболевания у новорожденного при инфицировании вирусом простого герпеса (менингоэнцефалит, сепсис); смерть наступает в 50% случаев. Выжившие дети в дальнейшем имеют тяжелые осложнения (неврологические расстройства, нарушения зрения, отставание психомоторного развития). Неонатальный герпес встречается с частотой 20-40 случаев на 100 тыс. новорожденных.
Цитомегаловирусная инфекция. Возможны такие акушерские осложнения, как самопроизвольные выкидыши, преждевременные роды, антенатальная гибель и аномалии развития плода, многоводие, неразвивающаяся беременность. Вероятность инфицирования при латентном течении инфекции практически отсутствует, при реактивации и персистенции составляет 0,5-7% и при первичной инфекции превышает 40%. Классическими проявлениями цитомегаловирусной болезни являются гепатоспленомегалия, тромбоцитопения, нарушения развития головного мозга (микроцефалия, интракраниальная кальцификация), энцефалит, хориоретинит, пневмония и внутриутробная задержка роста. Летальность при врожденной цитомегалии составляет 20-30%.
Коксаки-вирусная инфекция. В I триместре беременности эта инфекция встречается редко, приводит к формированию пороков развития желудочно-кишечного и урогенитального трактов, ЦНС. При инфицировании в поздние сроки беременности у новорожденного возможны следующие клинические проявления: лихорадка, отказ от еды, рвота, гипотония, кожные высыпания, судороги. У части новорожденных отмечаются отит, назофарингит, пневмония.
ВИЧ-инфекция. Возможность внутриутробного заражения плода от матери, инфицированной ВИЧ, подтверждают случаи обнаружения антигенов вируса в тканях плода и в амниотической жидкости. Имеется три пути преодоления вирусом плацентарного барьера: 1) перенос свободного вируса в результате повреждения плацентарного барьера и взаимодействия с Т4-рецепторами лимфоцитов плода; 2) первичное инфицирование плаценты, вторичное - плода; носителями вируса яв-
ляются клетки Гофбауэра плаценты, посредством которых возможна диаплацентарная передача; 3) переход вируса во время родов из пораженных клеток области шейки матки и влагалища через слизистые оболочки плода. ВИЧ-инфекцию приобретают 20-30 % новорожденных от инфицированных матерей. У детей, инфицированных ВИЧ, отмечаются кожные поражения в виде бактериальной, грибковой и вирусной экзантемы.
Бактериальная инфекция. Развитию внутриутробной бактериальной инфекции способствует наличие фокальных очагов (тонзиллит, гайморит, кариозные зубы, пиелонефрит, хронические и острые заболевания легких и др.) Возбудители могут проникать к плоду через плаценту. Восходящая инфекция чаще имеет место при нарушении целости плодного пузыря во время беременности или в родах. Помимо этого, восходящему инфицированию способствуют кольпиты, цервициты, инвазивные методы оценки состояния плода (амниоскопия, амниоцентез и др.), многочисленные влагалищные исследования в родах, истмикоцервикальная недостаточность, угроза прерывания беременности. При генерализованном микробном обсеменении околоплодных вод хориоамнионит проявляется повышением температуры, ознобом, тахикардией, гноевидными выделениями из половых путей и другими симптомами. У плода диагностируется начавшаяся гипоксия.
Среди ВУИ бактериальной природы превалируют ЗППП. К наиболее распространенным возбудителям урогенитальных инфекций относится Chlamydia trachomatis. Хламидии поражают преимущественно клетки цилиндрического эпителия. Больше чем у половины инфицированных женщин клинических проявлений нет.
Клиническими проявлениями хламидийной инфекции у новорожденных являются конъюнктивит, возникающий в нетипичные для ВУИ сроки - через 1-2 нед, а иногда и через 5 нед после рождения, и интерстициальная пневмония, развивающаяся в течение 2-4 мес с момента рождения. Такие отдаленные сроки проявления инфицирования свидетельствуют о преимущественном пути заражения плода хламидиями при непосредственном контакте с родовыми путями матери, хотя не исключается и восходящий путь инфицирования через неповрежденные плодные оболочки.
Микоплазменная инфекция. Микоплазмоз при беременности развивается преимущественно у лиц с иммунодефицитными состояниями. Урогенитальный микоплазмоз может привести к ВУИ, являющейся
причиной невынашивания, мертворождения; у недоношенных новорожденных микоплазмы вызывают развитие пневмонии, менингита, генерализованной инфекции.
Врожденный сифилис. Заболевание полисистемное, имеет различные формы. Его проявления напоминают вторичный сифилис. Большинство детей при рождении выглядят здоровыми, у некоторых имеются везикулезно-буллезные высыпания на ладонях и подошвах, однако спустя 4 дня - 3 нед после рождения могут появиться следующие симптомы заболевания.
Гриппоподобный синдром:
Менингеальные симптомы;
Слезотечение (воспаление радужной оболочки);
Отделяемое из носа, слизистые оболочки гиперемированы, отечны, эрозированы, изобилуют бледными трепонемами;
Ангина (на слизистой оболочке глотки имеются папулы);
Генерализованная артралгия (из-за болей отсутствуют активные движения в конечностях - псведопаралич Парро, на рентгенограмме отмечаются признаки остеохондрита, часто выявляется периостит, в частности, большеберцовых костей (саблевидные голени).
Увеличение всех групп лимфатических узлов (шейные, локтевые, паховые, подмышечные, подколенные).
Гепатоспленомегалия (в тяжелых случаях - анемия, пурпура, желтуха, отеки, гипоальбуминемия).
Высыпания:
Пятнисто-папулезные;
Слияние папулезных поражений с образованием широких кондилом.
Листериоз. У беременных листериоз может протекать в виде гриппоподобного заболевания, в субклинической форме со стертой симптоматикой. Отмечаются аборты или преждевременные роды, мертворождения или уродства плода, несовместимые с жизнью. У плодов листериоз проявляется в виде гранулематозного сепсиса или септикопиемии с метастатическим гнойным менингитом; у новорожденных наиболее часты сепсис и пневмония. Летальность новорожденных при листериозе достигает 60-80%.
Токсоплазмоз. Заболевание чаще возникает при близком контакте с животными. Женщины заражаются либо спородонтами из почвы (по-
павшими туда с фекалиями животных, например кошки), с рук, мебели, пола, либо цистозоидами из цист токсоплазм, содержащимися в тканях промежуточных хозяев (при употреблении в пищу недостаточно термически обработанного мяса). Клиническая картина характеризуется полиморфизмом (наличие или отсутствие лихорадки, увеличение лимфатических узлов, печени и селезенки, миокардит, пневмония и др.). При токсоплазмозе возможны развитие эндометрита, поражение плаценты, угроза прерывания беременности, гипотрофия плода.
Кандидоз. Нередко во время беременности развивается урогенитальный кандидоз. Это состояние, как и бактериальный вагиноз, является фоном для присоединения другой бактериальной и/или вирусной инфекции.
диагностика
Достоверных методов диагностики ВУИ плода не существует. Можно лишь ее предположить по косвенным признакам и установить инфицированность плода и плодного яйца.
У новорожденного инфекция проявляется либо с момента рождения, либо в течение 3-4 дней (за исключением хламидиоза и ряда других инфекций, которые могут проявляться позже). Диагностические признаки ее зависят от локализации или степени генерализации процесса.
В диагностике ВУИ основными являются бактериологические и иммунологические методы. К ним относятся обнаружение в посевах этиологически значимых микроорганизмов в количестве, превышающем 5х10 2 КОЕ/мл, и ПЦР, осуществляемая для идентификации определенных фрагментов ДНК или РНК клеток возбудителя.
Посевы и соскобы (для выявления внутриклеточно расположенных возбудителей) у беременных берутся из влагалища и канала шейки матки. У беременных группы высокого риска развития ВУИ прибегают к инвазивным методам получения материала для бактериологического изучения (аспирация хориона в ранние сроки беременности, исследование амниотической жидкости после амниоцентеза и пуповинной крови, полученной путем кордоцентеза). Бактериологические исследования должны сочетаться с идентификацией антигена в крови серологическими методами определения IgM и IgG, которые специфичны для того
или иного возбудителя. Исследования целесообразно повторять не реже 1 раза в 2 мес.
В настоящее время большое значение придается УЗИ, с помощью которого можно определить косвенные признаки ВУИ плода.
Косвенные УЗИ-признаки ВУИ
Симптом задержки роста плода.
Аномальное количество околоплодных вод (чаще многоводие).
Признаки преждевременного или запоздалого созревания плаценты. Нарушение ее структуры (варикозное расширение ее сосудов, наличие гиперэхогенных включений, отек плаценты, контрастирование базальной пластины).
Неправильной формы расширения межворсинчатого пространства, не соответствующие центрам котиледонов.
Раннее появление дольчатости плаценты.
Расширение чашечно-лоханочной системы почек плода.
Микро- и гидроцефалия.
Расширение желудочков мозга, повышение эхогенности ткани мозга, кистозные изменения или очаги кальцификации (некроз) в перивентрикулярной зоне мозга, ткани печени.
Асцит, перикардиальный или плевральный выпот, гепатомегалия, гипоэхогенный кишечник, водянка плода.
К скрининговым тестам у новорожденных группы высокого риска развития ВУИ можно отнести исследование мазков околоплодных вод, плаценты, посевы пуповинной крови и содержимого желудка новорожденного. В отдельных случаях рекомендуется исследование культуры крови новорожденного, причем наиболее целесообразен забор капиллярной, а не пуповинной крови. Производится определение активности щелочной фосфатазы, подсчет числа тромбоцитов (признаком инфицирования считают тромбоцитопению ниже 150х10 9 /л), соотношения юных форм лейкоцитов и нейтрофилов и радиоизотопное определение В-лактамазы (для выявления инфицирования В-лактамазопродуцирующими микроорганизмами). Большое значение имеет гистологическое исследование последа, хотя воспалительные изменения не всегда соответствуют заболеванию ребенка. В диагностике вирусных инфекций может быть полезно исследование фиксированной формалином ткани плаценты методом ПЦР. При проведении серологического обследования у новорожденного ребенка (IgG, IgM) следует помнить о следующих принципах:
Обследование новорожденного должно быть проведено до начала использования в лечении ребенка препаратов донорской крови;
Результаты обследования ребенка всегда необходимо сопоставлять с результатами обследования матери;
Наличие специфических иммуноглобулинов класса G в титре, равном или меньшем, чем титр соответствующих антител матери, свидетельствует не о внутриутробной инфекции, а о трансплацентарной передаче материнских антител;
Наличие специфических иммуноглобулинов класса М в любом титре свидетельствует о первичном иммунном ответе плода или новорожденного на соответствующий бактериальный/вирусный антиген и является косвенным признаком инфекции;
Отсутствие специфических иммуноглобулинов класса М в сыворотке крови новорожденных не исключает возможность внутриутробной или интранатальной инфекции.
Сравнительный анализ основных методов обнаружения возбудителей ВУИ отражен в табл. 25.
профилактика и лечение
Важное значение в профилактике ВУИ отводится выделению групп риска. Многочисленные факторы риска могут быть разделены на следующие три группы.
Хронические инфекционные заболевания: хронические инфекции органов дыхания, пищеварения, кариес, тонзиллит; урогенитальные инфекции (пиелонефриты, кольпиты, ЗППП); дисбактериоз кишечника, бактериальный вагиноз.
Осложнения беременности: анемия, гестозы, невынашивание беременности, истмико-цервикальная недостаточность и ее хирургическая коррекция, обострение хронических заболеваний и ОРВИ во второй половине беременности.
Осложнения родов: ОРВИ в родах, дородовое излитие вод; слабость родовой деятельности; затяжное течение родов; многократные влагалищные исследования; родоразрешающие операции и пособия; длительный безводный промежуток.
Метод | Чувствительность | Специфичность | Субъективность оценки | Достоинства | Недостатки |
Культуральный | Близка к абсолютной | Присутствует | Высокая точность. Выявляет только живые микроорганизмы. Высокая достоверность положительного результата | Высокая себестоимость, трудоемкость. Доступен лишь для крупных центров. Жесткие требования по забору, транспортировке, хранению материала. Неприемлем на фоне антибиотиков |
|
Близка к абсолютной | Близка к абсолютной | Практически отсутствует | Высокая точность. Высокая достоверность отрицательного результата. | Выявляет как живые, так и убитые микроорганизмы - ограничение для контроля излеченности. Опасность ложноположительного результата вследствие контаминации |
|
Иммуноферментный анализ (ИФА): | Удовлетворительная | Удовлетворительная | Отсутствует | Удовлетворительная точность при невысокой себестоимости. | Чувствительность и эффективность различны для разных возбуди- |
Продолжение табл. 25
выявление антигенов | Удобен для массовых исследований | телей, в связи с чем имеются тест-системы для диагностики ограниченного ряда инфекций. Малоэффективен при латентных и хронических инфекциях |
|||
Реакция иммунофлюоресцен- ции (РИФ) | Удовлетворительная | Удовлетворительная | Не требует жестких условий по организации лаборатории и дорогого, оборудования Удовлетворительная точность при невысокой себестоимости | Субъективизм в оценке. Низкая воспроизводимость при межлабораторном контроле |
|
Цитологический | Дешевизна, быстрота | Субъективизм в оценке. Низкая точность |
|||
Иммуноферментный анализ (ИФА): выявление антител | Удовлетворительная | Отсутствует | Выявляет наличие инфекции любой локализации. Выявляет острые, хронические и латентные формы инфекции (IgM, IgG в динамике) | Ретроспективная постановка диагноза (для IgG). Возможен ложноотрицательный результат при иммунодефиците. Иммунологический след - после излеченности IgG длительное время остается положительным |
Существуют общие принципы профилактики и лечения при ВУИ.
1. Этиотропная противомикробная (противовирусная) терапия с учетом стадии, общих и локальных симптомов, длительности течения инфекционно-воспалительного заболевания, наличия смешанной инфекции, срока гестации, клинико-лабораторных признаков ВУИ.
2. Профилактика (лечение) нарушений функции фетоплацентарного комплекса в 10-12, 20-22 и 28-30 нед беременности, а также в индивидуальные критические сроки и в комплексе пренатальной подготовки (метаболическая терапия, вазоактивные препараты и антиагреганты).
3. Иммуномодулирующая, интерферонкорригирующая терапия: растительные адаптогены, виферон.
4. Коррекция и профилактика нарушений микробиоценозов организма беременной: бифидумбактерин, лактобактерин (не менее 15 доз в сутки), флорадофилус (1 капсула 2 раза) энтерально 10-14 дней; в сочетании с ацилактом или лактобактерином вагинально.
5. Предгравидарная подготовка.
6. Лечение половых партнеров при наличии ЗППП.
Ряд профилактических мероприятий в большинстве экономически развитых стран мира, в том числе в РФ, давно стали узаконенными государством (реакция Вассермана, определение в сыворотке крови австралийского антигена, HCV-антител и антител к ВИЧ). Дети должны быть вакцинированы против гепатита В непосредственно после рождения, через неделю, через месяц и через 6 мес жизни для предотвращения развития тяжелых форм заболевания. При гепатите А специфических методов лечения нет. Для профилактики тяжелого течения можно использовать иммуноглобулин 0,25 мл на 1 кг массы тела.
Женщин, ранее не болевших краснухой, не получавших прививки против краснухи и, следовательно, не имеющих антител к вирусу краснухи, рекомендуется вакцинировать до предполагаемой беременности. Вакцинация должна быть выполнена за 3 мес до наступления беременности. Беременная женщина, особенно относящаяся к группе риска, должна избегать любого контакта с больным экзантемной инфекцией. В случае заболевания краснухой в первые 16 нед беременности показано ее прерывание.
Если инфицирование произошло на более поздних сроках, тактика индивидуальная, целесообразно провести исследование IgM пуповинной крови (кордоцентез), вирусологическое или ПЦР-исследование ам-
ниотической жидкости или биоптата хориона (амниоцентез). При подтвержденном заражении плода прерывание беременности желательно.
Для женщин, отказавшихся прервать беременность на сроке >16 нед, мерой профилактики инфекции у плода может быть введение специфического IgG.
Введение гамма-глобулина больным краснухой в период гестации незначительно снижает частоту аномалий развития плода. Вакцинация беременных не проводится.
При заболевании беременной ветряной оспой за 5-7 дней до родов или в первые 3-4 дня после родов показано немедленное введение новорожденному иммуноглобулина Zoster или иммуноглобулина Varicella-Zoster. При развитии заболевания у новорожденного (несмотря на проведение профилактических мероприятий) рекомендуется лечение ацикловиром в дозе 10-15 мг на 1 кг массы тела 3 раза в день. Лечение заболевших беременных ацикловиром проводится только при тяжелом течении заболевания.
При паротите и кори вакцинация беременных не проводится, так как используется живая ослабленная вакцина. Против гриппа имеется инактивированная вакцина типов А и В. При вакцинации риск для плода отсутствует. Прививать беременных женщин рекомендуется по строгим эпидемиологическим показаниям во II и III триместрах.
Поскольку при парвовирусной инфекции специфической терапии нет, для профилактики тяжелых осложнений рекомендуется использовать иммуноглобулин.
При наличии у беременной герпетической инфекции характер профилактических и лечебных мероприятий, акушерская тактика будут зависеть от типа заболевания, его формы (типичная, атипичная, бессимптомная, длительность течения), а также от наличия поражения гениталий, состояния плодных оболочек и пр.
При первичном инфицировании беременной в ранние сроки беременности необходимо ставить вопрос о ее прерывании. Если же патология возникает в более поздние сроки или же женщина была инфицирована до наступления беременности, профилактические мероприятия заключаются в проведении динамического УЗ-контроля за развитием и состоянием плода, назначении курсовой терапии, включающей метаболический комплекс, стабилизаторы клеточных мембран, унитиол.
Базисным противовирусным препаратом является ацикловир (зовиракс). Несмотря на недоказанность его тератогенного и эмбриотокси-
ческого эффектов, назначение ацикловира беременным, страдающим генитальным герпесом, целесообразно ограничить следующими показаниями: первичный генитальный герпес; рецидивирующий генитальный герпес, типичная форма; генитальный герпес в сочетании с перманентной угрозой прерывания беременности или симптомами ВУИ. Ацикловир назначают по 200 мг 5 раз в день в течение 5 дней. Вопрос о более длительном применении препарата и повторных курсах лечения решается индивидуально. Отмечается высокая эффективность средства в профилактике перинатальной инфекции. У беременных с частыми рецидивами инфекции имеется положительный опыт перманентной терапии ацикловиром (супрессивная терапия). При осложненном течении герпетической инфекции (пневмония, энцефалит, гепатит, коагулопатия) лечение проводится совместно с инфекционистом. Требуется внутривенное введение препарата в дозе 7,5 мг/кг через 8 ч в течение 14 дней. Одновременно целесообразно использовать иммуноглобулинотерапию, препараты интерферона, антиоксиданты (витамины Е и С). Среди интерферонов предпочтение следует отдать виферону, назначаются также адаптогены растительного происхождения. Возможно применение лазерного облучения крови, плазмафереза и энтеросорбции. Необходимо также лечение бактериальных заболеваний, сопутствующих генитальному герпесу (чаще всего хламидиоза, микоплазмоза, трихомониоза, кандидоза, бактериального вагиноза). После комплексной терапии осложнения для матери и плода снижаются в 2-3 раза.
Особого внимания заслуживает тактика ведения родов у женщин с первичным и рецидивирующим герпесом. Кесарево сечение в качестве профилактики неонатального герпеса необходимо при наличии герпетических высыпаний на гениталиях или первичного генитального герпеса у матери за 1 мес и менее до родов. В случае абдоминального родоразрешения на фоне разрыва плодных оболочек безводный промежуток не должен превышать 4-6 ч.
Лечение и профилактика цитомегаловирусной инфекции довольно затруднительны. Лечение заключается в проведении курсов пассивной иммунизации. Возможно применение противоцитомегаловирусного иммуноглобулина по 3 мл внутримышечно 1 раз в 3 дня, 5 инъекций на курс. Более эффективно лечение человеческим иммуноглобулином (внутривенное введение по 25 мл через день, 3 инфузии на курс). Интраглобин-Ф вводят из расчета 4-8 мл на 1 кг массы тела 1 раз в 2 нед при профилактическом применении. Количество профилактических
инфузий, а также режим профилактического лечения определяются индивидуально. Цитотект при доказанной цитомегаловирусной инфекции с лечебной целью вводят по 2 мл на 1 кг массы тела через каждые 2 дня под контролем серологических показателей. Профилактическая дородовая подготовка включает инфузию 5 мл цитотекта 2 раза в неделю в течение 2 нед. В любом случае ожидаемая польза от применения иммуноглобулинов должна превышать риск возможных осложнений (аллергическая и пирогенная реакции, выработка антител - антигаммаглобулинов, обострение инфекции). Специфический противовирусный препарат ганцикловир применяют по строгим витальным показаниям со стороны матери и новорожденного. Для профилактики осложнений также применяется виферон.
В настоящее время для лечения СПИДа используют зидовудин и другие нуклеозидные аналоги, обладающие противовирусной активностью. Фактов тератогенного действия данных препаратов не установлено, однако применение их у ВИЧ-инфицированных в ранние сроки беременности должно быть строго обоснованным. Главная цель назначения препаратов серопозитивным беременным - предотвращение передачи вируса плоду (она осуществляется через плаценту или новорожденному - при прохождении через инфицированные родовые пути, а особенно часто - через грудное молоко и при тесном контакте с матерью). Зидовудин назначают в дозе 300-1200 мг/сут. Хотя опыт применения его ограничен, назначение зидовудина ВИЧ-инфицированным беременным может быть действенным методом профилактики развития ВИЧ-инфекции у детей раннего возраста. Кормление ребенка грудью прекращается.
При наличии признаков бактериальной внутриматочной инфекции проводят интенсивную антибиотикотерапию (пенициллины, цефалоспорины). Новорожденному, родившемуся с признаками ВУИ, назначают антибактериальную терапию первоначально теми же антибиотиками, а затем - в зависимости от выделенной микрофлоры и ее чувствительности к антибиотикам.
Профилактика врожденного хламидиоза носит аналогичный характер. При беременности для лечения заболевания применяются макролиды (эритромицин 500 мг внутрь 4 раза в день в течение 10-14 дней). Джозамицин (вильпрафен) по спектру антимикробного действия близок к эритромицину, практически не дает побочных эффектов, не разрушается в кислой среде желудка, а по антихламидийному действию при-
равнивается к доксициклину. Препарат назначают по 2 г в сутки в 2-3 приема в течение 10-14 дней. Спирамицин (ровамицин) применяют по 3 000 000 ЕД 3 раза в сутки (не менее 7 дней). При индивидуальной непереносимости природных макролидов допустимо назначение клиндамицина внутрь по 0,3-0,45 г 3-4 раза в день или внутримышечно по 0,3-0,6 г 2-3 раза в сутки.
Лечение больных с урогенитальной инфекцией, вызванной Mycoplasma hominis и Ureaplasma urealytica, необходимо начинать сразу же после подтверждения диагноза лабораторными методами. Проводится лечение беременной и ее супруга. Оно существенно не отличается от такового при урогенитальном хламидиозе. Во время беременности предпочтение следует отдавать ровамицину и вильпрафену. На фоне антибактериальной терапии целесообразно назначение эубиотиков (ацилакт, лактобактерин). Необходимо отметить, что более действенной профилактикой ВУИ, обусловленных микоплазмозом и хламидиозом, является лечение женщин вне беременности, когда возможно применение более широкого спектра антибактериальных (тетрациклины, фторхинолоны и др.) и иммуностимулирующих средств (декарис, продигиозан, тактивин и т.д.).
Профилактика врожденного токсоплазмоза
Выявление женщин, впервые инфицированных во время данной беременности (по нарастанию титра антител в парных сыворотках), своевременное решение вопроса о прерывании беременности.
Лечение во время беременности для предупреждения передачи инфекции плоду.
Обследование и лечение новорожденных.
Серологический контроль за неинфицированными женщинами на протяжении всей беременности.
Лечение проводится сульфаниламидами.
Препарат выбора при лечении листериоза - ампициллин (пенициллин), применяемый в дозах 6-12 г/сут при выраженных формах заболевания и 3-4 г/сут при незначительных его проявлениях - ежедневно в течение 2-4 нед. Беременных и родильниц следует изолировать. Лечение новорожденных с листериозом представляет большие трудности и должно начинаться как можно раньше. Препарат выбора - ампициллин, назначается внутримышечно по 100 мг/кг 2 раза в день в течение 1-й недели жизни и по 200 мг/кг 3 раза в день в воз-
расте старше 1 нед. Продолжительность курса лечения составляет 14-21 день.
Лечение больных сифилисом во время беременности проводят согласно общим принципам и методам терапии этой инфекции. При каждой последующей беременности больной сифилисом необходимо проводить специфическое лечение. Обязательным является трехкратное серологическое обследование каждой беременной в первой, во второй половине беременности и после 36 нед беременности.
При урогенитальном кандидозе у беременных предпочтительно использовать местную терапию (клотримазол, миконазол, изоконазол, натамицин). Целесообразность энтерального назначения противогрибковых средств определяется наличием или отсутствием кандидоза ЖКТ. Рецидивирующий вагинальный кандидоз является показанием для обследования на вирусные и бактериальные инфекции, передаваемые половым путем. Больных следует информировать о том, что им самим и их половым партнерам рекомендуется обследование, при необходимости - лечение, воздержание от половой жизни до выздоровления или применение барьерных методов предохранения.
Бактериальный вагиноз - это клинический синдром, характеризующийся замещением нормальной микрофлоры влагалища, в которой преобладают лактобациллы, условно-патогенными анаэробными микроорганизмами. При лечении беременных предпочтительнее интравагинальное введение клиндамицина фосфата в виде 2% вагинального крема по 5 г на ночь 7 дней или 0,75% метронидазол-геля по 5 г на ночь также 7 дней со II триместра беременности. При недостаточной эффективности местной терапии возможно пероральное применение следующих препаратов: клиндамицин по 300 мг 2 раза в сутки в течение 5 дней или метронидазол по 500 мг 2 раза в сутки в течение 3-5 дней. Целесообразно использование эубиотиков, витаминов и других средств, способствующих нормализации микробиоценоза влагалища и кишечника.
Вопросы профилактики и лечения при ВУИ нельзя считать полностью решенными. Обоснованность профилактического назначения антибиотиков беременным и новорожденным групп высокого риска развития ВУИ - до сих пор предмет дискуссии, хотя большинство клиницистов считают подобные мероприятия целесообразными.
В связи с отсутствием возможности проведения у беременных массивной комплексной антибактериальной терапии при планировании в
семье ребенка задолго до наступления беременности следует лечить супружескую пару в качестве предгравидарной подготовки.
Схема предгравидарной подготовки
1. Комплексное обследование с изучением иммунного, гормонального, микробиологического статуса, диагностикой сопутствующих экстрагенитальных заболеваний, консультациями смежных специалистов.
2. Иммуностимулирующая, иммунокорригирующая и интерферонкорригирующая терапия:
Медикаментозная терапия (пирогенал, продигиозан, тактивин, иммунофан, специфическая иммуноглобулинотерапия и вакцинотерапия, ридостин, ларифан, виферон), лазеротерапия, плазмаферез;
Фитотерапия (женьшень, элеутерококк, аралия, лимонник и т.д.)
3. Этиотропная антибактериальная или противовирусная терапия по показаниям:
Тетрациклины;
Макролиды;
Фторхинолоны;
Клиндамицин, рифампицин;
Цефалоспорины;
Ацикловир, ганцикловир.
4. Эубиотическая терапия:
Для перорального применения - бифидумбактерин, лактобактерин, флорадофилус, солкотриховак;
Для вагинального использования - бифидумбактерин, ацилакт, лактобактерин, «Жлемик», «Наринэ».
5. Метаболическая терапия.
6. Коррекция нарушений менструального цикла и сопутствующих эндокринопатий.
7. Обязательное лечение полового партнера при наличии ЗППП, с применением индивидуальных схем при хронических воспалительных заболеваниях гениталий.
Таким образом, наибольшая опасность внутриутробного инфицирования грозит тем детям, матери которых первично инфицируются ВУИ во время беременности. Для таких инфекций, как краснуха, токсоплазмоз, первичное инфицирование беременной является единственным вариантом заражения плода. Как показывают расчеты, выявление жен-
щин групп риска на этапе планирования беременности и проведение соответствующих профилактических мероприятий может снизить риск ВУИ с тяжелыми последствиями на 80%.
Осуществление массового скрининга на ВУИ в настоящее время едва ли представляется возможным по финансовым соображениям. Однако в тех случаях, когда будущая мать со всей ответственностью подходит к рождению ребенка и обращается к акушеру-гинекологу на стадии планирования беременности, необходимо назначить минимальный объем исследований на ВУИ - определение IgG к основным возбудителям - цитомегаловирусу, токсоплазме, вирусу простого герпеса, вирусу краснухи. Результаты исследования дадут возможность выяснить, относится ли женщина к какой-либо группе риска. Проведение профилактических мероприятий (например, вакцинация в случае краснухи), а также соблюдение женщиной из группы риска рекомендаций по предотвращению инфицирования во время беременности позволит значительно снизить риск ВУИ у будущего ребенка.
Второй важный аспект обследования на ВУИ до беременности - возможность доказательства первичного инфицирования беременной. О его наличии свидетельствует сероконверсия IgG, требующая применения инвазивных методов обследования плода или прерывания беременности на ранних сроках.. Если беременная впервые обращается по поводу постановки на учет во II или III триместре, определение антител класса IgG к ВУИ теряет свою актуальность, более информативно в данном случае определение антител класса IgM, являющихся показателем первичного инфицирования и реактивации хронической инфекции, а также ПЦР-исследование.
При этом лабораторные методы следует рассматривать как вторичные по отношению к клиническому обследованию (в том числе УЗИ). Для диагностики генитального герпеса, хламидиоза, микоплазмоза у беременных более эффективны прямые методы (ПЦР и др.).
Любые инфекционные заболевания во время беременности могут стать причиной заражения плода. Признаки патологии появляются не сразу, а последствия могут быть самыми тяжелыми. Внутриутробная инфекция (ВУИ) тяжело диагностируется и плохо поддается лечению. Изменения у плода проявляются неспецифическими симптомами, по которым не всегда можно заподозрить инфекцию.
Этиология и распространенность
Причины развития внутриутробной инфекции плода связны с заражением матери во время беременности или с активацией хронической инфекции. Точная частота и распространенность не установлена, не все беременности с инфекцией завершаются родами, а причины выкидыша на раннем сроке установить не всегда возможно. По данным различных исследований, внутриутробная инфекция сопровождает до 10% всех беременностей.
Этиологическими факторами выступают различные виды микроорганизмов:
- вирусы краснухи, герпеса, гепатита, ВИЧ;
- бактерии сифилиса, туберкулеза, ИППП;
- простейшие: токсоплазма;
- грибки рода кандида.
Также часто встречается сочетание нескольких возбудителей.
Существует понятие TORCH-комплекса. Эта аббревиатура обозначает латинские названия наиболее часто встречающихся возбудителей заболеваний плода. К ним относятся:
- Т – токсоплазмоз;
- О – другие возбудители, к которым относятся сифилис, гепатит, микоплазма, кандидоз и многие другие инфекции;
- R – краснуха;
- С – цитомегаловирус;
- Н – герпес.
Внутриутробные инфекции у новорожденных в 30% случаев является причиной смерти до 1 года, а в 80% – врожденных пороков развития.
Чаще всего плод поражают вирусы, гораздо реже – бактерии и грибы. Они могут вызывать заболевание вторично, после активации вирусов.
Последствия в зависимости от срока инфицирования
Наибольшую опасность для будущего ребенка представляет первичное заражение матери во время беременности. Ее организм должен усиленно вырабатывать защитные антитела, поэтому не способен защитить плод. Если происходит активация или повторная встреча с возбудителем, то последствия менее значимы. У матери уже имеются антитела к возбудителю, поэтому болезнь протекает значительно легче, а ребенок защищен материнским иммунитетом.
Последствия внутриутробной инфекции для плода зависят от срока, когда произошло заражение. В первые 2 недели формирования эмбриона происходит нарушение закладки основных тканей, поэтому возникает самопроизвольный . Более правильно назвать исход бластопатии биохимической беременностью, т.к. плодное яйцо может находиться на начальном этапе имплантации, а женщина не будет знать о своем положении. Беременность в таком случае можно зарегистрировать только по анализам крови.
При проникновении возбудителя в сроке 2-10 недель гестации формируются тяжелые пороки развития, которые являются следствием повреждения клеток и нарушения закладки органов. Они часто несовместимы с жизнью и заканчиваются внутриутробной гибелью, мертворождением или смертью в первые месяцы жизни.
Заражение плода в сроке 11-28 недель гестации вызывает фетопатии. Организм плода уже способен на воспалительный ответ, поражаются только некоторые органы. Но механизм воспаления не полный. После первой фазы – альтерации, нет второй – экссудации, в результате которой происходит приток лейкоцитов и выделение веществ, которые направлены на локализацию инфекционного агента. Выражена третья фаза воспаления – пролиферация, когда происходит усиленный синтез соединительной ткани и отграничение патологического очага. Поэтому дети, зараженные в этом сроке, рождаются с пороками отдельных органов, часто – с фиброэластозом, гидронефрозом, поликистозом.
Если инфицирование плода протекает в позднем сроке, 28-40 недель, то возникает полноценная воспалительная реакция, в которую вовлекаются несколько органов. Ребенок рождается с энцефалитом, нефритом, гепатитом, пневмонией.
Заражение может произойти и в момент родов. Развивается воспаление одного-двух органов, чаще всего страдают нижние дыхательные пути и печень, диагностируется пневмония и гепатит.
Признаки заражения
Клинические признаки инфекционного процесса у плода неспецифические. Во время беременности некоторые инфекции могут протекать у женщин с минимальными проявлениями. Признаки внутриутробной инфекции плода включают диагностированную фетоплацентарную недостаточность и (ЗРП). Воспалительные процессы часто сопровождаются многоводием, реже возникает маловодие.
Низкая плацентация также может быть показателем наличия инфекции в матке, часто это хронические воспалительные процессы по типу эндометрита.
На внутриутробное заболевание указывает увеличение размеров печени и селезенки плода. Заподозрить патологию можно при рождении ребенка со стигмами дисэмбриогенеза. Это малые аномалии развития, которые существенно не влияют на общее состояние здоровья, но указывают на заболевания, которые протекали внутриутробно. К ним относятся:
- аномалии строения черепа, низкий лоб, большие надбровные дуги;
- изменения разреза глаз, формы челюсти и подбородка, искривление носа;
- чрезмерно оттопыренные уши, отсутствие естественных искривлений, козелка;
- искривления шеи, складки кожи на ней;
- изменения формы грудной клетки, грыжи живота;
- короткие или длинные пальцы, их сращение, поперечная борозда на ладони, искривление пальцев;
- увеличение клитора, крипторхизм, маленькие половые губы;
- родимые и пигментные пятна, гемангиомы.
Но для диагностики патологий, возникших внутриутробно, необходимо обнаружение 5 и более стигм.
У новорожденного могут быть дыхательные расстройства, болезни сердечно-сосудистой системы. Физиологическая желтуха переносится тяжелее, имеет более длительное течение. Кожа может покрываться сыпью, имеются неврологические расстройства, лихорадочные состояния.
Но точный диагноз можно установить только после диагностики.
Факторы риска

Механизм передачи внутриутробной инфекции может быть трех типов:
- восходящий – из половых путей матери;
- трансплацентарный – из очагов хронической или острой инфекции в материнском организме;
- нисходящий – через маточные трубы;
- интранатальный – во время родов.
Учитывая возможные пути заражения плода, женщине в период прегравидарной подготовки необходима санация очагов имеющейся инфекции. Обязательно достижение ремиссии при хронических инфекционных патологиях (тонзиллит, синусит, цистит), санация ротовой полости, лечение кариозных зубов.
Определены факторы риска, которые увеличивают вероятность развития ВУИ. Острый воспалительный процесс, который возник во время беременности, особенно впервые, значительно увеличивает шансы заражения плода. В первом триместре, когда еще не сформирована плацента, больше вероятность влияния бактериальной флоры. В последующих триместрах, когда плацента уже способна задерживать крупные клетки возбудителей, чаще развивается вирусная патология.
Хронические очаги могут привести к распространению возбудителей гематогенно, лимфогенно или имплантационно. Увеличивается риск заболевания при снижении иммунитета. Небольшая иммуносупрессия является естественным процессом. Это происходит под влиянием прогестерона, который подавляет местную защиту для предотвращения отторжения плодного яйца, частично являющегося чужеродным материнскому организму. Но длительно текущие хронические заболевания, соматические патологии, переохлаждение и перегрев, стрессовые ситуации могут еще больше подавить иммунитет.
Нарушение плацентарной проницаемости, которое возникает при патологическом течении беременности увеличивает возможность перехода инфекционного агента к плоду. Поражается и сама плацента, в ней могут появляться очаги кровоизлияний, кальцинаты и различные включения, которые ухудшают поступление крови к плоду. Это ведет к его хронической и задержке развития.
Плохие социально-бытовые условия также являются фактором риска. Возникают условия к нарушению гигиены, возможен контакт с инфекционными больными. Женщины из низких социальных слоев чаще оказываются зараженными половыми инфекциями.
Характеристика основных инфекций
Для каждого заболевания характерны свои признаки, патогенез, особенности течения и внутриутробного заражения.
Токсоплазмоз
Врожденный токсоплазмоз развивается при заражении после 26 недели, вероятность такого исхода увеличивается с приближением момента родов. Если инфицирование происходит на начальных сроках, происходит самопроизвольный выкидыш или гибель плода.
Классической триадой признаков являются хориоретинит, микроцефалия и гидроцефалия. Но она не всегда встречается. Учитывая тяжелые пороки развития плода и его инвалидизацию, беременным, перенесшим токсоплазмоз, предлагают прерывание по медицинским показаниям до 22 недель.

Простой герпес
Вирусы простого герпеса являются наиболее распространенными среди взрослых людей. Первый тип преимущественно проявляется в виде высыпаний на губах, а второй поражает аногенитальную область. Вирусы могут долго находиться в латентном состоянии, проявляться только в момент ослабления иммунитета.
Плацента хорошо защищает плод от заражения, поэтому случаи врожденного герпеса редкие. Внутриутробная герпетическая инфекция возможна при виремии у матери при первичном заражении во время гестации. Если это происходит на ранних сроках, возможно самопроизвольное прерывание беременности. В поздних сроках для ВУИ характерны поражения различных органов.
Генитальный герпес в позднем сроке может привести к заражению во время родов. Если это рецидив заболевания у матери, то ребенок будет защищен ее антителами. При первичной инфекции происходит тяжелое поражение новорожденного.
Для новорожденного герпес угрожает неврологическими осложнениями. Тяжесть их зависит от времени заражения. Чем раньше, тем обширнее повреждения нервной системы и тяжелее проявления. Признаки поражения нервной системы, энцефалит проявляются не сразу, а через 2 недели после рождения. При отсутствии лечения в 17% наступает смерть.

При первичной инфекции генитального герпеса (на позднем сроке) происходит тяжелое поражение новорожденного, зачастую приводящее к летальному исходу
Корь
Вирус передается воздушно-капельным путем. Беременность не влияет на клинические проявления патологии. Влияние вируса кори на вынашивание ребенка неоднозначно. Риск тератогенного действия невысокий, но имеются сведения о поражении плодных оболочек и угрозе преждевременных родов у женщин, болеющих корью.
Новорожденный заболевает только в случае, если мать заболевает за 7 дней до родов или в течение недели после них. Проявления патологии могут быть различными – от легкого течения до молниеносного, которое заканчивается летально. Заражение постанатально приводит к легким проявлениям болезни, не опасным для ребенка.
Диагностика проводится по характерной клинической картине и с помощью определения антител. Лечение симптоматическое.
Вакцинация от кори во время гестации противопоказана. Но эта патология входит в календарь профилактических прививок, проводимых в детском возрасте.
Многочисленные виды внутриутробных инфекций диагностируются во время беременности только при возникновении клинических проявлений болезни. Исключение составляют такие опасные заболевания, как ВИЧ, сифилис. Также женщина обязательно обследуется на гонорею. Мазки, которые берут с установленной периодичностью и при возникновении жалоб на выделения, помогают санировать половые пути и предотвратить заражение во время родов.